العنصر الذي عدد الإلكترونات له يساوي 6
جدول المحتويات
العنصر الذي عدد الإلكترونات له يساوي 6، الذرةُ هي أصغر وحدة بنائية للمادة، وتتكونُ من جسيمات، وهي البروتونات التي تحملُ الشحنة الموجبة، والالكترونات التي تحملُ الشحنة السالبة، والنيوترونات عديمةَ الشحنة، وعند دراسةِ هذه الخواص لا بدّ من التعرف على العدد الذري والعدد الكتلي، ومن خلال موقع المرجع سنتعرفُ على كيفية حسابهما.
العدد الذري والعدد الكتلي
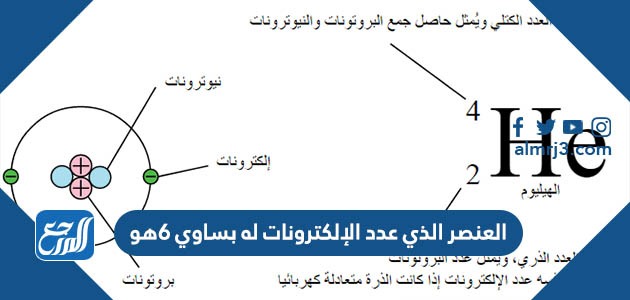
يُعرّف العدد الذري (Atomic number) على أنّه عدد الالكترونات أو البروتونات في الذرة، ويرمز له بالرمز z، ويختلفُ من ذرة عنصر لعنصر آخر، فكلُ عنصر في الجدول الدوري يكونُ له عدد ذري مُختلف عن أي عنصر آخر، تعقيبًا على ذلك فإنّه يمكنُ تمييز أي عنصر ومعرفة خواصه الكيميائية من خلالِ معرفة عدده الذري، والعدد الذري في نواةِ العنصر ثابت، فمثلاً العدد الذري لعنصرِ الهيدروجين يساوي 1 بمعنى أنّ عدد البروتونات = 1، فيما يُعرّف العدد الكتلي (Mass number ) على أنّه مجموع عدد البروتونات والنيوترونات في الذرة، ويرمز له بالرمز A، والعددُ الكتلي لأيّ ذرة يُساوي الكتلة الذرية لها ( تُعبر عن كتلة الذرة) مُقربةً لأقرب عدد صحيح، ويكونُ الثابت الوحيد في نواة ذرة العنصر هو عدد البروتونات، وما إنْ تغيرت فإنّ العدد الكتلي سيتغير.[1]
العنصر الذي عدد الإلكترونات له يساوي 6
العدد الذري هو عدد الإلكترونات في الذرة، فما العنصرُ الذي عدد الإلكترونات له يساوي 6 ؟
- عنصر الكربون ( C ) .
فعنصرُ الكربون عنصرٌ لافلزي يقع ضمن عناصر الدورة الثانية، وفي بدايةِ المجموعة الرابعة عشر في الجدولِ الدوري، ولهُ أربع الكترونات مُتاحة في المدار الأخير حيثُ يحلل عددهُ الذري { 2،4 } ، ويمكنُ لهذه الالكترونات الأربع وأن ترتبطُ بروابط تساهمية مع ذرات أخرى في مدارها الأخير، وتعدُّ مركبات الكربون العضوية من أكثرِ المركبات دخولاً في أشكال الحياةِ اليومية في كافةِ النواحي الحيوية والتطبيقية.
شاهد أيضًا: حددي إلكترونات التكافؤ للعنصر التالي na العدد الذري 11
طريقة كتابة العدد الذري والعدد الكتلي
حتى تُميّز العدد الذري عن العدد الكتلي في العناصر المُختلفة فإنّه يجب أن تتعرف على طريقة كتابتهما، كالآتي:
- يُكتب العدد الذري للعنصر أسفل يسار العنصر، ومثالٌ على ذلك:
- العددُ الذري لعنصر النيتروجين يساوي 7، ويكتب على الصيغة الآتية: 7N
- يُكتب العدد الكتلي أعلى يسار العنصر، ومثالُ على ذلك:
- العدد الكتلي لعنصر النيتروجين يساوي 14، ويكتبُ على الصيغة الآتية: 14N
- العددُ الذري والعدد الكتلي للعنصر يكتبانِ معًا على النحو الآتي:
- ذرة النيتروجين: 147N
شاهد أيضًا: رتبت العناصر في الجدول الدوري بناء على كتلها الذريه
حساب العدد الذري والعدد الكتلي
من خلالِ التعريف المُسبق فإنّه يمكن استنتاج كيفية حساب العدد الذري والعدد الكتلي عن طريقِ الآتي:
- العدد الكتلي = عدد البروتونات + عدد النيوترونات
- العدد الذري = عدد البروتونات
كما ويمكنُ إيجاد عدد النيوترونات من خلالِ المعادلة الآتية:
- عدد النيوترونات= العدد الكتلي – العدد الذري
أمثلة على حساب العدد الذري والعدد الكتلي
تُساعد الأمثلة التوضيحية على فهمِ كيفية ايجاد العدد الذري والكتلي، ومنّها:
- المثالُ الأول: ما هو عدد النيوترونات في ذرة البورون (B) ، علمًا بأنّ عددها الذري 5، وعددها الكتلي 11 ؟
- يمكنُ ايجاد عدد النيوترونات من خلال المعادلة الآتية:
- عدد النيوترونات= العدد الكتلي – العدد الذري = 11 – 5
- عدد النيوترونات = 6 نيوترون
- المثالُ الثاني: العدد الذري لذرة البريليوم (Be) يساوي 4، وعدد النيوترونات فيها يساوي 6، فما هو العدد الكتلي لها ؟
- العدد الذري = عدد البروتونات
- العدد الكتلي = عدد البروتونات + عدد النيوترونات = 4 + 6
- العدد الكتلي = 10
- المثالُ الثالث: ذرة الفلور العدد الذري لها 9، ما ما هو عدد البروتونات والإلكترونات؟
- العدد الذري = عدد البروتونات = عدد الالكترونات
- بالتالي فإنّ: عدد البروتونات = 9
- عدد الالكترونات = 9
الى هُنا نكون قد وصلنا الى نهايةِ مقالنا العنصر الذي عدد الإلكترونات له يساوي 6، حيثُ سلطنا الضوء على تعريفِ العدد الذري والكتلي، وكيفية حسابهما في أيّ ذرة.
المراجع
- khanacademy.org , Atomic number, atomic mass, and isotopes , 30/09/2021