قوى التجاذب والتنافر بين جسيمات الغاز
جدول المحتويات
قوى التجاذب والتنافر بين جسيمات الغاز في الطبيعة، حيث إن الغازات إحدى حالات المادّة الأساسيّة، وهي الحالة الصلبة والسائلة والغازيّة، وتختلف كل حالة عن الأخرى بعدد من الصفات الفيزيائية والكيميائية التي تساعد في دراستها خصوصًا في التحريك الحراري، ومن أهم وجوه الاختلاف قوى التجاذب والتنافر بين الجزيئات، ومن هذا المنطلق يهتم موقع المرجع بتعريفنا على الغازات وأهم خواصها ثم التطرّق لشرح بعضها بشكل مبسّط.
قوى التجاذب والتنافر بين جسيمات الغاز
الغازات عبارة عن موائع لا تقاوم أي تغيير لشكلها، ولكنّها تملأ أي فراغ تكون فيه على عكس السوائل التي تعد أيضًا من الموائع، مما لا يجعل لها حجم ثابت، وذلك يكون بسبب أن قوى التجاذب والتنافر بين جسيمات الغاز تكون:
- معدومة.
لا يوجد قوى تجاذب أو تنافر بين جزيئات الغاز مما يسمح له بملئ الفراغ الموضوع فيه بسهولة، ونتيجة لعدم وجود قوى التجذب والتنافر فإنّ حركة الغازات تكون حرّة.[1]
شاهد أيضًا: ماتسارع العربه اذا كانت كتلتها ٢٥ كجم وتدفع بقوه ١٠ نيوتن
خواص الغازات
تمتلك الغازات عدد من الخصائص الهامّة، ونعدد من هذه الخصائص ما يلي:
- القابلية للانضغاط: حيث أن المسافات التي تتركها جزيئات الغاز فيما بينها تعتبر كبيرة نسبيًا مما يسهّل انضغاطها.
- الانتشار السريع: وذلك ممكن لأن قوى التجاذب والتنافر بين جزيئات الغاز تكاد تكون معدومة، مما يسمح لهذه الجزيئات بالانتشار بشكل أسرع من الحالة السائلة والصلبة.
- الحركة الدائمة: تكون حركة جزيئات الغاز عشوائيّة وسريعة، وتزداد سرعة هذه الحركة مع ارتفاع درجة حرارة الغاز، وينتج عن الحركة العشوائية تصادم الجزيئات في الغاز.
- الحجم والشكل المتغيرين: حيث أن قوى التجاذب المعدومة في الغازات تجعل منها غير مقاومة لأي تغيير يطرأ على شكلها ويسمح لها بملء الوعاء الذي توضع فيه.
- الكثافة المنخفضة: وذلك بسبب المسافات الكبيرة المتروكة بين جزيئات الغاز .
شاهد أيضًا: هو عنصر الكتروني يعمل بناء على مستوى إشارة الجهد الداخل اليه
التصادم بين جسيمات الغاز
تكون التصادمات بين جسيمات الغاز عبارة عن تصادمات مرنة بحيث لا تضيع الطاقة الحركيّة للجسيمات فيها، وسبب التصادمات هو الحركة العشوائية لجسيمات الغاز، وتزداد التصادمات في أي غاز بارتفاع درجة حرارته مما يؤدي لازدياد سرعة الجسيمات، أو بازدياد ضغط الغاز الذي يسبب تقريب المسافات بين جسيمات الغاز مع المحافظة على حركتها العشوائيّة.[1]
شاهد أيضًا: تعرف السرعة على انها قطع مسافة معينة في أقل زمن ممكن
كثافة الغازات
بما أن الغازات تتألف من عدد من الجسيمات المتناهية في الصغر والبعيدة عن بعضها البعض فهي تملك كثافة منخفضة، حيث أن الكثافة هي عبارة عن الكتلة لوحدة الحجم، أي بمعنى آخر هي كتلة لتر واحد من المادة، أو كتلة متر مكعب من المادة، وتزداد قوى التجاذب والتنافر بين جسيمات الغاز بازدياد كثافته، وبما أن المسافات بين الجسيمات بعيدة فإن كثافته تكون منخفضة، وتزداد كثافة الغاز بازدياد ضغطه.[1]
شاهد أيضًا: عندما تفتح صنبور الماء الساخن لغسل الأواني فان انابيب المياه تسخن
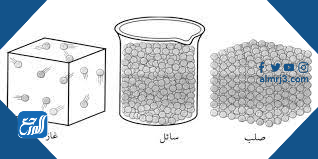
قارن بين حركة الجزيئات في حالات المادة الثلاث
يمكن المقارنة بين حركة الجزيئات في كل من السائل والصلب والغاز على النحو التالي:
| الحالة الصلبة | الحالة السائلة | الحالة الغازيّة |
|---|---|---|
| حركة الجزيئات تذبذبية، أي أنها تبقى في مكانها | تتحرك الجزيئات بشكل أكثر من المادة الصلبة ولكن في مكانها | حركة الجزيئات عشوائية |
| تكون الجزيئات قريبة جدًا من بعضها | تكون أبعد عن بعضها من الجسيمات في المادة الصلبة | الجسيمات متباعدة بشكل كبير |
| الروابط بين الجسيمات قويّة | قوة أضعف منها في الحالة الصلبة ولكن أقوى من الروابط في الحالة الغازية | قوى الروابط بين الجسيمات ضعيفة جدًا |
شاهد أيضًا: أي العبارات التالية صحيح عندما تستخدم المستوى المائل لرفع كرسي ثقيل مقارنة برفعه رأسياً
قوى التجاذب والتنافر بين جسيمات الغاز تعتبر معدومة، وذلك يعود لعدد من الأسباب أهمها المسافات الكبيرة بين جسيمات الغاز، مما يجعل تأثير هذه القوى ضعيف جدًا ويكاد معدوم، لذلك تكون كثافة الغاز منخفضة ويسهل أن يتغير شكله وحجمه ليتناسب مع شكل وحجم الوعاء الذي يوضع فيه دون إبداء أي مقاومة تُذكر في تغيير شكل الغاز.
المراجع
- wikiwand.com , غاز , 06/10/2021