بحث عن حالات المادة وتحولاتها

جدول المحتويات
بحث عن حالات المادة وتحولاتها من الأبحاث المهمة التي يقوم الطلاب بإعدادها ضمن مادة العلوم؛ باعتبار هذا الموضوع من الموضوعات المهمة التي توضح للطالب التحولات الفيزيائية بين المادة في حالاتها المختلفة التي تمكنهم من تفسير الكثير من الظواهر البيئية التي تحدث حولنا على هذا الكوكب المليء بالأسرار. وسوف يزودكم موقع المرجع هنا بنموذج بحث شامل ومتكامل عن المادة وحالاتها الصلبة والسائلة والغازية.
مقدمة بحث عن حالات المادة وتحولاتها
بسم الله الرحمن الرحيم، والحمد لله رب العالمين، وصلوات ربي وسلامه على سيدنا محمد وعلى آله وصحبه أجمعين، أما بعد:
في الكون من حولنا تحدث الكثير من الظواهر التي ما كنا لنعرف ماهيتها أو نفسرها لو لم نتعلم عن حالات المادة والتحولات التي تجري بينها للانتقال من حالة إلى أخرى، ففي الشتاء نرى السماء تمطر بعد أن تتجمع الغيوم التي تحمل معها كميات كبيرة من المياه، وقد نتساءل كيف يمكن لهذا أن يحدث هل يمكن أن يأتي الماء من لا شيء؟ بالطبع لا، إنما هو تحولات في حالات المادة لها علاقة باكتسابها للطاقة أو فقدانها يمكن تفسيرها بطريقة علمية، وهذا بالضبط هو ما سوف يتم توضيحه في هذا البحث.
شاهد أيضًا: بحث عن الغازات وخصائصها كامل
بحث عن حالات المادة
عند كتابة بحث عن حالات المادة يذكر الكثير من الناس أن المادة ثلاث حالات وهذا هو المشتهر، إلا أنني في هذا المقال سوف أدرج أربع حالات المادة وأتحدث عن خصائص كل حالة بالتفصيل، من خلال إفراد كل واحدة من الحالات في باب على الترتيب الآتي:
- الحالة الصلبة.
- الحالة السائلة.
- الحالة الغازية.
- حالة البلازما.
تعريف المادة
يمكن تعريف المادة بأنها شيء له كتلة ويحتل مساحة، والمادة توجد في شكلها الطبيعي بواحدة من الحالات الأربعة: صلبة أو سائلة أو غازية أو بلازما. ويمكن أن يتم تحويل المادة من حالة إلى أخرى من خلال إمدادها بالطاقة أو سحبها في معادلات ماصة أو طاردة للطاقة، وتتكون المادة من مزيج من الذرات التي تشكل العناصر والمركبات، وهي اللبنات الأساسية للكون.
على المستوى الأكثر تجريدًا، يتكون الكون من المادة والطاقة التي تمثل قدرة الأشياء على فعل أي شيء وفقًا لمبدأ تكافؤ الكتلة؛ حيث ينص مبدأ تكافؤ الكتلة والطاقة على أن المادة هي شكل آخر من أشكال الطاقة بما يتناسب مع المعادلة الآتية:
- E = mc2، حيث E: هي الطاقة، m: هي الكتلة (كمية المادة) و c: هي سرعة الضوء والتي يتم تربيعها.
الحالة الصلبة
المادة في الحالة الصلبة تتكون من جسيمات (الأيونات أو الذرات أو الجزيئات) متجمعة معًا بشكل وثيق، بحيث تكون القوى بين الجسيمات قوية فلا تستطيع الجسيمات التحرك بحرية ولكن يمكنها الاهتزاز فقط. نتيجة لذلك، يكون للمادة الصلبة شكل ثابت ومحدد وحجم محدد. ولا يمكن للمواد الصلبة تغيير شكلها إلا بالقوة، كما هو الحال عند كسرها أو قطعها. في المواد الصلبة البلورية، تترتب الجسيمات (الذرات أو الجزيئات أو الأيونات) في نمط متكرر مرتب بانتظام؛ حيث إن هناك العديد من الهياكل البلورية المختلفة. [1]
كما يمكن أن تحتوي نفس المادة على أكثر من هيكل واحد أو طور صلب، وعلى سبيل المثال، يحتوي الحديد على هيكل مكعب محوره الجسم عند درجات حرارة أقل من 912 درجة مئوية، وبنية مكعبة محورها الوجه بين 912 و 1394 درجة مئوية، أما الجليد فله خمس عشرة بنية بلورية معروفة، أو خمس عشرة مرحلة صلبة والتي توجد في درجات حرارة وضغوط مختلفة. يمكن تحويل المواد الصلبة إلى سوائل عن طريق الذوبان ويمكن أيضًا أن تتحول مباشرة إلى غازات من خلال عملية التسامي. [1]
الحالة السائلة
السائل هو عبارة عن واحدة من حالات المادة تكون فيها غير قابلة للضغط وتتوافق مع شكل الوعاء الخاص بها، إلا أن السائل يحتفظ بحجم ثابت تقريبًا مستقل عن الضغط، حيث يكون هذا الحجم محدد إذا كانت درجة الحرارة والضغط ثابتين. وطريقة تكوينه هي عندما يتم تسخين مادة صلبة فوق نقطة انصهارها فإنها تصبح سائلة. وفي الحالة السائلة تكون القوى بين الجزيئات (أو بين الذرات) قوية، لكنها لديها طاقة كافية للتحرك بالنسبة لبعضها البعض فتكون البنية بشكل عام متحركة؛ مما يعني أن شكل السائل ليس محددًا ولكن يتم تحديده من خلال وعائه.
وعادة ما يكون حجم السائل أكبر من حجم المادة الصلبة التي تكون منها، إلا أن لكل قاعدة شواذ، والاستثناء الأكثر شهرة في هذه القاعدة هو الماء (H2O)، لأنه عند درجات معينة من التجمد سوف يزداد حجمه عما كان عليه وهو في حالته السائلة؛ وهذا هو السبب في أننا لو وضعنا زجاجة مملوءة بالماء في مجمد الثلاجة فإنها سوف تنكسر وتتفتت. وإن أعلى درجة حرارة يمكن أن يوجد عندها سائل معين هي درجة الحرارة الحرجة، أي تلك الفاصلة بين الحالة السائلة والغازية.
شاهد أيضًا: بحث عن علم الفيزياء وأهميته في حياتنا
الحالة الغازية
المسافات بين جزيئات الغاز كبيرة جدًا، حيث تحتوي جزيئات الغاز على روابط ضعيفة جدًا أو لا توجد روابط تقريبًا، لهذا يمكن للجزيئات الموجودة في “الغاز” أن تتحرك بحرية وسرعة، والغاز هو عبارة عن مائع قابل للانضغاط، فلن يتطابق الغاز مع شكل الوعاء فحسب، بل سوف يتوسع ويزداد حجمه أيضًا ليملأ الوعاء. وفي الغاز تمتلك الجزيئات طاقة حركية كافية بحيث يكون تأثير القوى بين الجزيئات صغيرًا أو صفرًا للغاز المثالي، وتكون المسافة بين الجزيئات أكبر بكثير من الحجم الجزيئي. فضلًا عن أن الغاز ليس له شكل أو حجم محدد، ولكنه يشغل الوعاء الذي يحصر فيه، ويمكن تحويل السائل إلى غاز بالتسخين عند ضغط ثابت إلى نقطة الغليان، أو عن طريق تقليل الضغط عند درجة حرارة ثابتة. [2]
عند درجات حرارة أقل من درجة الحرارة الحرجة، يسمى الغاز أيضًا بخارًا، ويمكن تسييله بالضغط وحده دون تبريد، كما يمكن أن يوجد البخار في حالة توازن مع سائل، وفي هذه الحالة يكون ضغط الغاز مساويًا لضغط بخار السائل؛ حيث إن المائع فوق الدرجة الحرجة هو غاز تكون درجة حرارته وضغطه أعلى من درجة الحرارة الحرجة والضغط الحرج على التوالي، وفي هذه الحالة يختفي التمييز بين السائل والغاز. ويحتوي السائل فوق الحرج على الخصائص الفيزيائية للغاز، ولكن كثافته العالية تمنح خصائص المذيبات في بعض الحالات، مما يؤدي إلى تطبيقات مفيدة. على سبيل المثال، يتم استخدام ثاني أكسيد الكربون فوق الحرج لاستخراج الكافيين في صناعة القهوة منزوعة الكافيين. [2]
حالة البلازما
في البلازما، تُمزق الإلكترونات بعيدًا عن نواتها، وتشكل بحرًا إلكترونيًا يعطيها القدرة على توصيل الكهرباء. والبلازما مثل الغازات ليس لها شكل أو حجم محدد. إلا أنها على عكس الغازات موصلة للكهرباء وتنتج مجالات مغناطيسية وتيارات كهربائية وتستجيب بقوة للقوى الكهرومغناطيسية؛ بحيث تسبح النوى الموجبة الشحنة في “بحر” من الإلكترونات المنفصلة تتحرك بحرية، على غرار الطريقة التي توجد بها هذه الشحنات في المعدن الموصل. في الواقع، هذا “البحر” الإلكتروني هو الذي يسمح للمادة في حالة البلازما بتوصيل الكهرباء.
غالبًا ما يُساء فهم حالة البلازما، لكنها في الواقع شائعة جدًا على سطح الأرض، ويشاهدها غالبية الناس بشكل منتظم دون أن يدركوا ذلك، فالبرق والشرر الكهربائي ومصابيح الفلورسنت وأضواء النيون وتلفزيونات البلازما وبعض أنواع اللهب والنجوم كلها أمثلة على مادة مضيئة في حالة البلازما. وعادة ما يتم تحويل الغاز إلى بلازما بإحدى طريقتين، إما من خلال فرق جهد كبير بين نقطتين، أو بتعريضه لدرجات حرارة عالية للغاية؛ حيث يؤدي تسخين المادة إلى درجات حرارة عالية إلى مغادرة الإلكترونات للذرات، مما يؤدي إلى وجود إلكترونات حرة.
شاهد أيضًا: بحث عن التفكير وأنواعه ومستوياته ومهاراته
خريطة مفاهيم عن حالات المادة
تسهل خريطة المفاهيم فهم المادة المطروحة بالنسبة للكثير من الطلاب الذين يعتمدون عليها في تنظيم أفكارهم وترتيب المعلومات بأسلوب يسهل عليهم الحفظ ويثبت المعلومات، وفيما يأتي سوف ندرج نموذج خريطة مفاهيم عن حالات المادة يمكن الاستفادة منه:
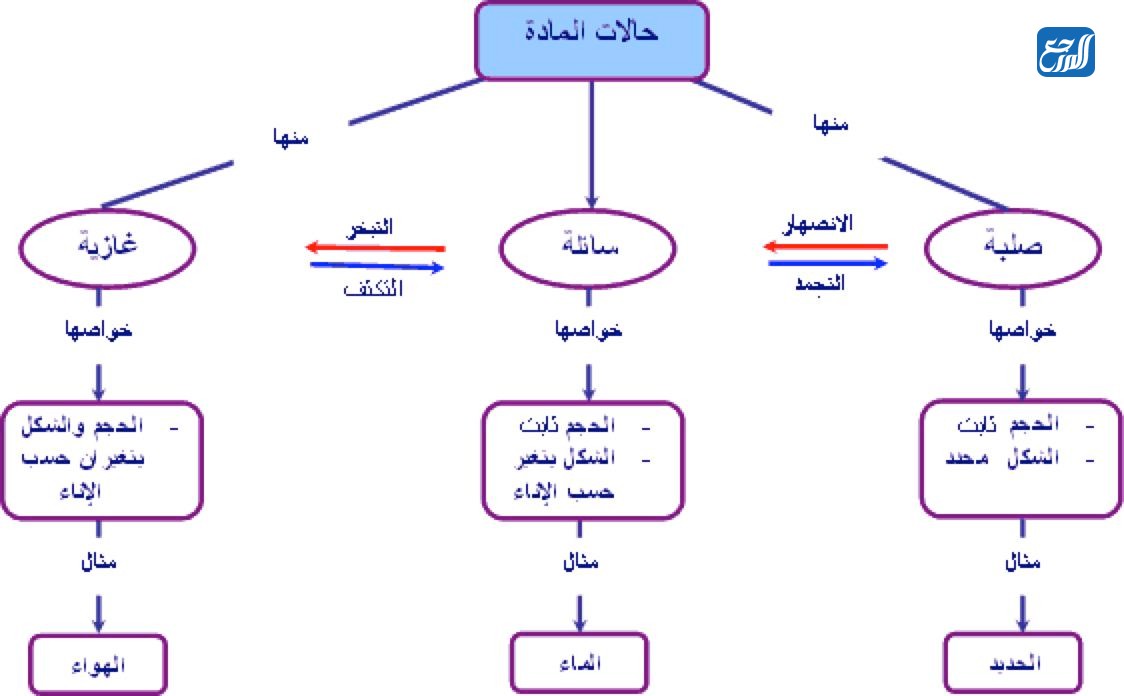
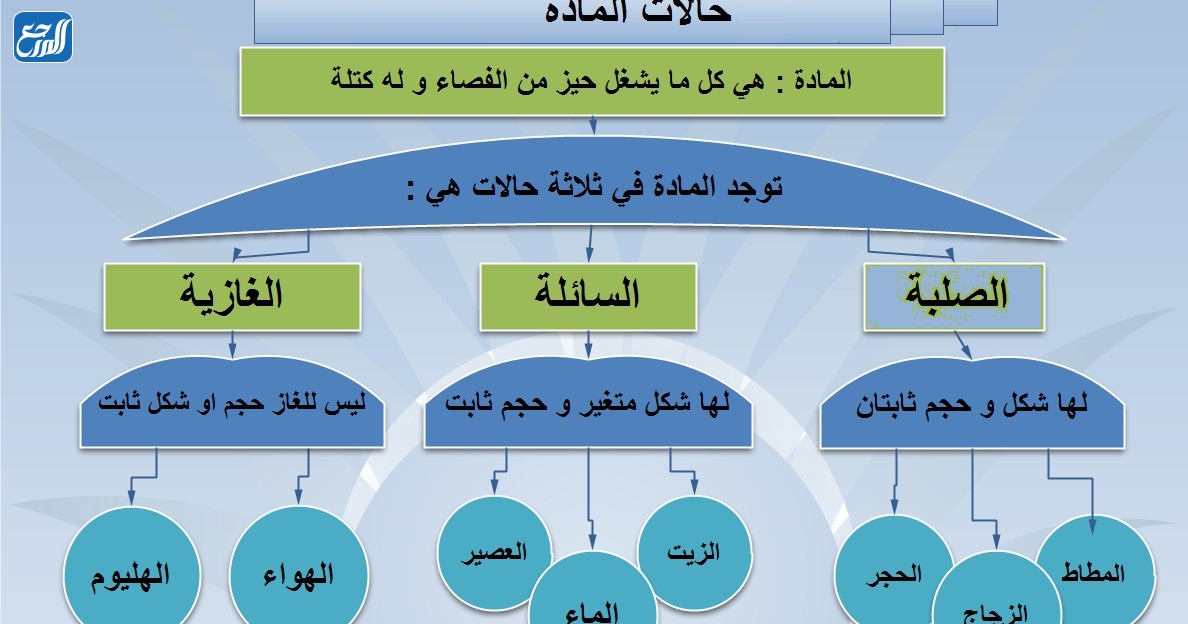
أمثلة عن حالات المادة
هناك العديد من الأمثلة التي نشاهدها دومًا في حياتنا تمثل أمثلة على حالات المادة، بل إن كل شيء في حياتنا له حالة معينة نراه فيها، وقد يتحول إلى غيرها باكتساب الطاقة أو فقدها:
| أمثلة على مواد في الحالة الصلبة | أمثلة على مواد في الحالة السائلة | أمثلة على مواد في الحالة الغازية | أمثلة على مواد في حالة البلازما |
| قالب طوب عملة قضيب حديدي موز صخر رمل زجاج ورق ألومنيوم جليد خشب |
دم عسل عصير ماء الزئبق (معدن سائل) بترول لبن الأسيتون كحول قهوة |
هواء غاز طبيعي هيدروجين ثاني أكسيد الكربون بخار الماء غاز الفريون الأوزون نتروجين أرجون غاز طبيعي |
برق النيون الأيونوسفير للأرض هالة الشمس أورورا كهرباء ساكنة حريق سانت إلمو النجوم سديم عادم الصواريخ |
حالات أخرى للمادة
في حين أن المواد الصلبة والسوائل والغازات والبلازما هي أكثر حالات المادة شيوعًا، فإن العلماء على دراية بالعديد من الحالات الأخرى التي تخرج عن نطاق هذه الحالات الثلاث وهي كما يأتي:
- البلورات السائلة: البلورة السائلة هي حالة وسيطة بين السائل والصلب.
- المائع الفائق: السائل الفائق مثل السائل ولكن بدون لزوجة.
- مكثف بوز-أينشتاين: يشبه مكثف بوز-أينشتاين غازًا شديد البرودة حيث تتوقف الجسيمات عن التصرف بشكل مستقل عن بعضها البعض.
- مكثف الزجاج الملون: مكثف الزجاج الملون هو نوع من المادة يتوقع وجودها في النوى الذرية التي تتحرك بسرعة تقترب من سرعة الضوء.
- المادة المظلمة: المادة المظلمة هي نوع من المادة لا تمتص الضوء ولا تصدره.
بحث عن تحولات المادة
المادة في الطبيعة توجد في الحالات التي ذكرناها آنفًا، لكن ما هي القوة التي تؤثر في المادة لتحولها من شكل إلى آخر، وماذا تسمى العملية التي تتحول المادة من خلالها، هذا هو الموضوع المهم الذي سوف نتناوله ضمن بحث عن حالات المادة باعتباره جزءًا أساسيًا يرتبط ارتباطًا وثيقًا بنطاق البحث. وفيما يأتي سوف يتم توضيح خذه التحولات مع شرح مبسط عنها: [3]
ذوبان المادة الصلبة
الذوبان هو العملية التي تتحول فيها المادة من الحالة الصلبة إلى الحالة السائلة، حيث تبقى المادة صلبة حتى تصل إلى درجة حرارة تكون فيها الطاقات الحرة للمرحلة الصلبة والسائلة متساوية تمامًا، وفي هذه المرحلة، يكون للمرحلتين احتمالات توازن متساوية. إلا أن وصول المادة إلى هذه الدرجة هذا لا يعني أن المادة سوف تبدأ على الفور في الذوبان، بل للقيام بذلك تحتاج إلى المزيد من الطاقة، وذلك انطلاقًا من أن الطور السائل يحتوي على طاقة أعلى من الطور الصلب.
وعند وصول المادة الصلبة إلى هذه المرحلة يمكن أن يتم تحويل المادة إلى السيولة من خلال إضافة المزيد من الحرارة، وستلاحظ أن درجة الحرارة لن ترتفع، وبدلاً من ذلك، تتحول المادة من الحالة الصلبة إلى الحالة السائلة، بينما تظل درجة الحرارة ثابتة. وتستمر هذه العملية حتى يذوب كل الجليد، عندها يمكن أن تبدأ درجة الحرارة في الارتفاع مرة أخرى، ويسمى فرق الطاقة بين المرحلتين الحرارة الكامنة للانتقال؛ إنها كمية “الحرارة الزائدة” التي يجب أن تضيفها إلى النظام لتحويل مرحلة إلى أخرى، فالحرارة الزائدة لا تساهم في تغيير درجة الحرارة، وفي أي وقت تلاحظ فيه حرارة كامنة، فهذه علامة أكيدة على حدوث انتقال طوري.
تبخر المادة السائلة
يحدث التبخر عند تسخين سائل، وعلى سبيل المثال، عندما تسخن الشمس الماء في بركة فإن البركة سوف تتقلص ببطء، فيبدو لك أن الماء يختفي، لكنه في الواقع ينتقل إلى الهواء كغاز يسمى بخار الماء، وهذا عبارة عن مثال يشرح عملية التبخر. فعندما يتم غليان الماء تتحرك جميع الجزيئات في السائل، والبعض يتحرك أسرع من البعض الآخر، وبشكل عام عندما تمتص الجزيئات الموجودة على سطح السائل الحرارة فإنها تبدأ في التحرك بسرعة أكبر مما يمنحها الطاقة اللازمة لكسر الروابط التي تربطهم بجزيئات الماء الأخرى، وعندما تتحرك الجزيئات بسرعة كافية فإنها تكون قادرة على الهروب؛ أي أنها تترك سطح السائل على هيئة جزيئات غاز.
تكاثف المادة الغازية
التكاثف هو العملية التي تتحول المادة من خلالها من الحالة الغازية إلى الحالة السائلة، ويمكن رؤية مثال على التكاثف عندما تتشكل قطرات من الماء على السطح الخارجي لكوب من الماء المثلج؛ حيث يبدو للناظر أن القطرات تظهر من العدم، إلا أنها تتكون في الواقع من بخار الماء الموجود في الهواء. كما أن الندى الذي يتشكل على العشب بين عشية وضحاها هو مثال آخر على التكثيف. ومن الجدير بالذكر أن التكيف يحدث عندما تبرد جزيئات الغاز، فعندما تفقد الجزيئات الحرارة، فإنها تفقد الطاقة وتتباطأ، فتقترب من جزيئات الغاز الأخرى، ثم أخيرًا تتجمع هذه الجزيئات معًا لتشكيل سائل.
تصلب المادة السائلة
التصلب والمعروف أيضًا باسم التجميد هو عبارة عن عملية تغيير طور للمادة ينتج عنه إنتاج مادة صلبة، وبشكل عام، يحدث هذا عندما تنخفض درجة حرارة السائل إلى ما دون نقطة التجمد. على الرغم من أن درجة التجمد ونقطة الانصهار لمعظم المواد هي نفس درجة الحرارة، فإن هذا ليس هو الحال بالنسبة لجميع المواد، لذا فإن نقطة التجمد ونقطة الانصهار ليست بالضرورة مصطلحات قابلة للتبادل. على سبيل المثال، الأجار – وهي مادة كيميائية تستخدم في الطعام والمختبر- يذوب عند 85 درجة مئوية (185 فهرنهايت) ومع ذلك يتجمد من 31 درجة مئوية إلى 40 درجة مئوية (89.6 فهرنهايت إلى 104 فهرنهايت).
دائمًا ما يكون التصلب عملية طاردة للحرارة، مما يعني إطلاق الحرارة عندما يتحول السائل إلى مادة صلبة، إلا أن الاستثناء الوحيد المعروف لهذه القاعدة هو تصلب الهيليوم منخفض الحرارة؛ بحيث يجب إضافة الطاقة (الحرارة) إلى الهيليوم 3 والهيليوم 4 حتى يحدث التجميد. وفي ظل ظروف معينة، قد يتم تبريد السائل تحت درجة التجمد، ولكن لا ينتقل إلى مادة صلبة، ويُعرف هذا باسم التبريد الفائق ويحدث لأن معظم السوائل تتبلور لتتجمد، ومن الممكن ملاحظة التبريد الفائق بسهولة عن طريق تجميد الماء بعناية، ويمكن أن تحدث هذه الظاهرة عندما يكون هناك نقص في مواقع التنوي الجيدة التي يمكن أن يبدأ التصلب منها، مع العلم أن التنوي هو عبارة ترتب جزيئات في مجموعات منظمة، وبمجرد حدوث التنوي يتقدم التبلور حتى يحدث التصلب.
ومن الأمثلة على التصلب التي يمكن العثور عليها في الحياة اليومية ما يأتي:
- تجميد الماء لتكوين ثلج في علبة مكعبات الثلج.
- تشكيل ثلج.
- تجمد الشمع المذاب.
- تصلب الحمم على هيئة صخور صلبة تسمى الصخور النارية.
التسامي
التسامي العملية التي يتم من خلالها تحول المادة من المرحلة الصلبة إلى المرحلة الغازية للمادة مباشرة، مع عدم وجود مرحلة سائلة وسيطة. وغالبًا ما يستخدم التسامي لوصف عملية تحول الثلج والجليد إلى بخار ماء في الهواء دون أن يذوب أولاً في الماء. وإنه ليس من السهل رؤية حدوث التسامي، على الأقل ليس من خلال تحول البخار إلى الجليد، وفي الواقع تعد أفضل طريقة لتصور التسامي هي عدم استخدام الماء على الإطلاق واستخدام ثاني أكسيد الكربون بدلًا من ذلك؛ لأن واحد من أهم التطبيقات على التسامي ما يعرف باسم الثلج الجاف الذي يكون في الواقع مادة صلبة عبارة عن ثاني أكسيد الكربون المجمد، والذي يحدث له أنه يتسامى أو يتحول إلى غاز في درجة حرارة باردة -78.5 درجة مئوية (-109.3 درجة فهرنهايت).
الترسيب
الترسيب هو عملية معاكسة لعملية التسامي، فهي تمثل تحول بخار الماء مباشرة إلى جليد من غير أن تمر بمرحلة السيولة بين الحالتين الصلبة والغازية، ومن الأمثلة على هذه العملية تكون رقاقات الثلج والصقيع في الطرقات على الرغم من عدم وجود الماء، وهذا هو أشهر الأمثلة عليها في الحياة اليومية.
شاهد أيضًا: بحث عن الكيمياء كامل
تعريف تحولات المادة باختصار
تؤدي التغيرات في درجة الحرارة والضغط إلى انتقال المادة من شكل إلى آخر. وأكثر تجوالات المواد شيوعًا سوف نذكرها مع تعريفها فيما يأتي:
- التجميد: التجميد هو الانتقال من الحالة السائلة إلى الحالة الصلبة.
- الترسيب: الترسب هو الانتقال من غاز مباشرة إلى مادة صلبة.
- الذوبان: يحدث الذوبان عندما تتحول المادة الصلبة إلى سائل.
- التكثيف: يحدث التكثف عندما ينتقل الغاز إلى سائل.
- التسامي: التسامي هو التغيير من مادة صلبة إلى غاز:
- التبخير: التبخير هو الانتقال من سائل إلى غاز.
- إعادة التركيب: إعادة التركيب أو نزع الأيونات هو التغيير من حالة البلازما إلى غاز.
- التأين: التأين هو تغيير الطور من غاز إلى بلازما.
خاتمة بحث عن حالات المادة وتحولاتها
وفي ختام هذا البحث نكون قد تناولنا حالات المادة الأربعة، وذكرنا أهم الخصائص التي تجعلها مميزة عن بعضها البعض وبينّا كيف يتم الانتقال بين هذه الحالات وعلاقة الطاقة بذلك، بالإضافة إلى إدراج مجموعة من الأمثلة التوضيحية للظواهر البيئية ذات العلاقة. وقبل أن أنهي هذا المقال أوصي بالاهتمام بهذا الموضوع لارتباطه الوثيق في بيئتنا وما يحدث فيها، بالإضافة إلى أن تعلم مثل هذه الأمور يدعم فهمنا للتطبيقات الكثيرة التي تعتمد عليها؛ وهذا يعني أن فائدتها ليست فائدة قاصرة. وفي الختام أتمنى أن أكون قد وفقت في سرد المعلومات وتوضيحها، وأتطلع إلى معرفة أي اقتراح ممكن للتطوير من هذا البحث المتواضع.
بحث عن حالات المادة وتحولاتها doc
تندرج حالات المادة ضمن المقرر الذي يتم تدريسه عادة لمادة العلوم وهي بالتحديد تتبع لعلم الفيزياء، وهي عبارة عن أربع حالات تنتقل بينها المادة من خلال اكتساب الطاقة أو فقدها. وإعداد الأبحاث عن هذا الموضوع يعد من الأمور المهمة جدًا لأنها تثبت في عقل الطالب المادة التي يدرسها من خلال البحث والتعلم الذاتي والتثبت مما درسه بالاطلاع على الظواهر البيئية التي لها علاقة بهذه التحولات، وتدعيم فهمه بالصور التي تبين هذه العملية بالتفصيل. ويمكن “من هنا” أن تقوموا بتحميل نموذج بحث عن حالات المادة وتحولاتها شامل ومتكامل بصيغة doc.
شاهد أيضًا: بحث عن الكيمياء العضوية كامل
بحث عن حالات المادة وخصائص كل حالة pdf
تمثل حالات المادة واحدة من أهم الموضوعات التي يجب تسليط الضوء عليها؛ وذلك لأنها ترتبط ارتباطًا وثيقًا بالظواهر البيئية التي نراها بانتظام، كما أن دراستها تعطينا فهمًا أعمق لما يتم إجراؤه في مختبرات العلوم من تجارب عن المادة وحالاتها، فضلًا عن أهميتها إثبات قانون حفظ المادة من خلال بيان أن ما يحدث للمادة ليس اختفاءً إنما تحولت من شكل إلى آخر من خلال اكتساب أو فقد الطاقة. ويمكنكم “من هنا” تحميل بحث عن حالات المادة وخصائص كل حالة المدعم بالرسومات والاستفاد مما فيه من معلومات قيمة.
شاهد أيضًا: بحث عن الطرائق العلمية في الكيمياء
إلى هنا نكون قد وصلنا إلى ختام هذا المقال، وقد أدرجنا لكم فيه بحث عن حالات المادة وتحولاتها فيه فقرات قيمة تحتوي شرح مبسط عن كل حالة وخصائصها، بالإضافة إلى خريطة مفاهيم مميزة عن حالات المادة يمكن الاستفادة منها.
المراجع
- livescience.com , Matter: Definition & the Five States of Matter , 27/10/2021
- courses.lumenlearning.com , States of Matter , 27/10/2021
- chem.libretexts.org , Fundamentals of Phase Transitions , 27/10/2021




















