التوزيع الإلكتروني الصحيح لعنصر الألومنيوم al13 هو
جدول المحتويات
التوزيع الإلكتروني الصحيح لعنصر الألومنيوم al13 هو من الأسئلة المهمة في مناهج الكيمياء السعودية، على اعتبار أن مفهوم التوزع الإلكتروني والسويات الطاقية من الأساسيات الهامة جدًا لفهم الذرة التي تعد نواة علم الكيمياء، وانطلاقًا من ذلك خصصنا هذا المقال عبر موقع المرجع لتوضيح التوزيع الصحيح لهذا العنصر مع ذكر القانون الأساسي المستخدم في عمليات التوزيع الإلكتروني لمختلف العناصر الأخرى.
السويات الطاقية في الذرة
وصف العلماء الذرة على أنها نواة ذات شحنة موجبة، تدور حولها إلكترونات سالبة الشحنة ضمن مدارات مقسمة إلى سبع سويات طاقية أساسية متمثلة فيما يلي: (K,L,M,N,O,P,Q)، مع العلم تبدأ هذه السويات بالمستوى K الأقل طاقة، وتنتهي بالمستوي Q الأعلى طاقة، على اعتبار أن تزداد طاقة السوية بالابتعاد عن النواة، ويكون توزع الإلكترونات ضمن كل مستوى وفق قانون سنذكره لاحقًا، مع العلم تم تقسيم المستوى الطاقي إلى مدارات فرعية أيضًا هي: (s, p, d, f)، إذ يتسع المستوى الفرعي s لإلكترونين، والمستوى الفرعي p إلى 6 إلكترونات، والمستوى الفرعي d إلى 10 إلكترونات، أما المستوى الفرعي f فيتسع إلى 14 إلكترون. [1]
شاهد أيضًا: أقصى عدد يمكن أن يسعه المستوى الفرعي في المستوى الثاني من الإلكترونات
التوزيع الإلكتروني الصحيح لعنصر الألومنيوم al13 هو
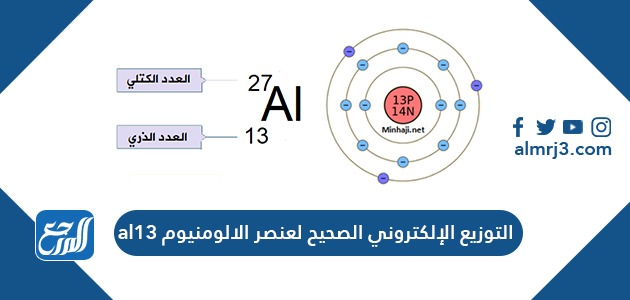
التوزيع الإلكتروني الصحيح لعنصر الألومنيوم al13 هو قائم على أساس قانون كيميائي محدد يعتمد على العدد الذري للعنصر، والإجابة الصحيحة هي: [1]
- 1S^2 2S^2 2P^6 3S^2 3P^1
بما أن التوزيع الإلكتروني يعتمد على العدد الذري للعنصر، وباعتبار أن العدد الذري للألومنيوم هو 13، أي علينا توزيع 13 إلكترونات في السويات الطاقية حسب سعتها العظمى التي تحدد من خلال القانون التالي: Y= 2n^2، حيث أن n هو رقم المستوى الطاقي، بناءً على ذلك ستكون السعة العظمى للمستوى K هي 2 والسعة العظمى للمستوى L هي 8، أما السعة العظمى للمستوي M فهي 27، وفقًا لعنصر الألومنيوم سيحتاج إلى المستويين L وK كاملين، في حين سيملأ ثلاث إلكترونات فقط من المستوي M، مما يفسر التوزيع الإلكتروني المذكور سابقًا.
شاهد أيضًا: التوزيع الالكتروني لعنصر li 3 هو
ما هو عنصر الألومنيوم
هو عنصر كيميائي خفيف الوزن فضي أبيض معدني من المجموعة الرئيسية في الجدول الدوري، ويعتبر العنصر المعدني الأكثر وفرة في القشرة الأرضية والأكثر استخدامًا على نطاق واسع، بسبب نشاطه الكيميائي، مع العلم لا يوجد الألمنيوم بشكله المعدني في الطبيعة، ولكن مركباته موجودة إلى حد كبير في جميع الصخور تقريبًا، ويمكن تلخيص خصائص هذا العنصر وفق التالي: [2]
- العدد الذري: 13.
- الوزن الذري: 26.9815384.
- نقطة انصهار: 660 درجة مئوية.
- نقطة الغليان: 2,467 درجة مئوية.
- الجاذبية المحددة: 2.70 (عند 20 درجة مئوية)
- التكافؤ: 3.
استخدامات عنصر الألومنيوم
بما أن الألومنيوم واسع الانتشار ونظرًا لصفاته المميزة، كان من البديهي وجود العديد من الاستخدامات الخاصة به، حيث يضاف الألومنيوم بكميات صغيرة إلى بعض المعادن لتحسين خصائصها واستخدامها في مجالات محددة، كما هو الحال في برونزيات الألومنيوم ومعظم سبائك قاعدة المغنيسيوم التي تستخدم على نطاق واسع لبناء الطائرات ومواد البناء والثلاجات ومكيفات الهواء وأواني الطبخ، والموصلات الكهربائية، والمعدات الكيميائية ومعدات تجهيز الأغذية، حيث أن هذا العنصر لين جدًا وخفيف الوزن، هذا فضلًا عن كونه موصلًا ممتازًا للحرارة والكهرباء، وعلى الرغم من أنه نشط كيميائيًا إلا أنه مقاوم للتآكل.
إلى هنا نكون قد وصنا إلى نهاية مقالنا التوزيع الإلكتروني الصحيح لعنصر الألومنيوم al13 هو الذي تحدثنا فيه عن التوزع الإلكتروني الصحيح لعنصر الألومنيوم سواء ضمن السويات الطاقية الأساسية أو الفرعية، مع توضيح أهم خصائص هذا العنصر واستخداماته.
المراجع
- courses.lumenlearning.com , Electron Configuration , 07/09/2021
- britannica.com , aluminum , 07/09/2021