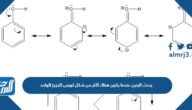
تعتمد طريقة عدد التأكسد لوزن معادلات الأكسدة، والاختزال على مساواة عدد الإلكترونات المفقودة من الذرات بعدد الإلكترونات المكتسبة من قبل ذرات أخرى
جدول المحتويات
تعتمد طريقة عدد التأكسد لوزن معادلات الأكسدة، والاختزال على مساواة عدد الإلكترونات المفقودة من الذرات بعدد الإلكترونات المكتسبة من قبل ذرات أخرى، فالتفاعلات الكيميائية أساس علم الكيمياء وتفسير الظواهر التي تعتمد على هذا العلم، بما في ذلك تفاعلات الأكسدة والاختزال، وفي مقالنا اليوم عبر موقع المرجع سوف نجيب على هذا السؤال المطروح، ونتعرف على ما هو مفهوم تفاعلات الأكسدة والاختزال، وما هي شروط موازنة تفاعلات الأكسدة والاختزال وما يخصها.
ما هو مفهوم تفاعلات الأكسدة والاختزال
تشمل تفاعلات الأكسدة والاختزال جميع التفاعلات الكيميائية التي تتغير فيها حالة تأكسد الذرات، ومن حيث التعريف العلمي، الأكسدة هي فقدان الإلكترونات أو ما يعرف علمياً باسم زيادة حالة الأكسدة، وذلك بواسطة جزيء أو ذرة أو أيون، أما الاختزال، فهو اكتساب الإلكترونات، أو ما يعرف علمياً بانخفاض حالة الأكسدة، وذلك بواسطة جزيء أو ذرة أو أيون.[1]
شاهد أيضًا: تزداد سرعة التفاعلات الكيميائية بزيادة درجة الحرارة
تَعتمد طريقة عدد التأكْسد لوزن مُعادلات الأكسدة، وَالاختزال على مُساواة عدد الإِلكترونات المفقودة مِن الذرات بعَدد الإلكترونات المكتسبة من قبل ذرات أخرى
في علم الكيمياء، يتطلب وصف التفاعل الكهروكيميائي الكلي لعملية الأكسدة والاختزال موازنة تفاعلات نصف المكون للأكسدة والاختزال، وهذا يعتمد على مساواة عدد الإلكترونات المفقودة من الذرات من المادة المؤكسدة، بعدد الإلكترونات المكتسبة من قبل ذرات أخرى والتي تمثل الوسط المُأكسد، وبناءً عليه، تمون هذه العبارة المذكورة في نص السؤال هي:[1]
- عبارة صحيحة
شاهد أيضًا: في المعادلة الكيميائية الموزونة، يمثل كل من عدد الجزيئات المنفردة، وعدد مولات الجزيئات ب.
شروط موازنة تفاعلات الأكسدة والاختزال
في البداية، تتطلب موازنة تفاعلات الأكسدة والاختزال تقسيم المعادلة إلى نصفي تفاعلات الاختزال والأكسدة، ويجب موازنة جميع الذرات باستثناء الأكسجين والهيدروجين أولاً، وفي الظروف الحمضية، يجب موازنة ذرات الأكسجين بالماء، بينما يجب موازنة ذرات الهيدروجين مع H +، أما في الظروف الأساسية، فيجب موازنة ذرات الأكسجين مع OH -، بينما يجب موازنة ذرات الهيدروجين بالماء، ويجب أن يكون رد الفعل المتوازن تمامًا عبارة عن تفاعلات نصف مضافة معًا مرة أخرى، ويتم هذا في ظل وجود ثلاث عوامل، وهي:[1]
- القاعدة أو الأساس: وهو متقبل بروتون أو مانح زوج إلكترون.
- أيون المتفرج: وهو أيون موجود كمتفاعل ومنتج في معادلة كيميائية.
- الحمض: وهو متقبل زوج الإلكترون، وبشكل عام يكون قادر على التبرع بأيونات الهيدروجين.
وبهذا القدر نصل إلى نهاية مقالنا الذي كان بعنوان تعتمد طريقة عدد التأكسد لوزن معادلات الأكسدة، والاختزال على مساواة عدد الإلكترونات المفقودة من الذرات بعدد الإلكترونات المكتسبة من قبل ذرات أخرى، والذي أجبنا من خلاله على هذا السؤال المطروح، كما تعرفنا على ما هو مخطط الساق والأوراق، كما تعرفنا على ما هو مفهوم تفاعلات الأكسدة والاختزال، وما هي شروط موازنة تفاعلات الأكسدة والاختزال.
المراجع
- courses.lumenlearning.com , Oxidation-Reduction Equations , 05/02/2022