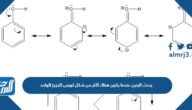
حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته.

جدول المحتويات
حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته.، تستخدم معادلات الحالة لوصف حالة الغازات والسوائل بصفة أساسية، ورغم أنها تصف سلوك غاز مثالي؛ إلا أنها تصف الغاز الحقيقي تحت ظروف معينة، وفيما يلي من هذا المقال عبر موقع المرجع، سنتعرف على كيفية حساب حجم الغازات، وقوانين الغازات الثلاث.
حساب حجم الغازات
المول الواحد من أي غاز يشغل حجم مقداره 24 لتراً؛ في درجة حرارة الغرفة؛ وفي الضغط الجوي، أي أن 2 مول من اي غاز يشغل حجما مقداره 72 لتراً، وهكذا، وبناء على ذلك؛ في التفاعلات الكيميائية تُحسب كمية الغاز المنبعثة خلال تفاعلٍ كيميائي؛ من حساب عدد المولات المتكونة؛ ثم يتم ضربها في 24 لترا.
حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته.
يتناسب حجم الغاز عكسيا مع الضغط الواقع عليه، بشرط ثبوت درجة الحرارة، وهذا ما نص عليه العالم بويل، فيما يُعرف بقانون بويل، حيث إن: P1×V1=P2×V2، وترمز P1، P2 إلى ضغط الغاز، V1، V2 حجم الغاز، وبالتالي نستنتج أن العبارة السابقة:[1]
- عبارة صحيحة، وهو نص قانون بويل.
قوانين الغازات
القوانين التي تربط بين ضغط الهواء وحجمه مع درجة الحرارة، هي:
- قانون بويل: وينص على يتناسب الحجم الذي تشغله كمية من الغاز تناسبا (عكسيا) مع ضغط الغاز، عند درجة حرارة ثابتة.
- قانون شارل: وينص على حدوث تناسب عكسي بين حجم كميات محددة من الغاز؛ مع درجة الحرارة (بالكلفن)؛ بشرط ثبوت الضغط.
- قانون جاي _ لوساك: حيث يكون التناسب طردياً بين ضغط مقدار محدد من الغاز مع درجة الحرارة بالكلفن؛ بشرط ثبوت الحجم.
إلى هنا، ينتهي هذا المقال، والذي قمنا من خلاله بتسليط الضوء على مدى صحة عبارة حَجم كمّية مُحدّدة مِن الغاز يَتناسَب عَكسياً مَع الضّغط الواقع عَليه عِند ثُبوت درجة حَرارته.، كما تعرفنا إلى كيفية حساب حجم الغازات، وقوانين الغازات.
المراجع
- wikiwand.com , معادلة حالة , 6/12/2022