ما المقصود بالقول ان للماء روابط مشتركة قطبية
جدول المحتويات
ما المقصود بالقول ان للماء روابط مشتركة قطبية وتحت أي بند يمكن تصنيف الروابط التي تجمع ذرات جزيء الماء، حيث أن هناك الكثير من المواد التي نشاهدها في حياتنا اليومية، ناتجة عن روابط كيميائية جمعت ذراتها، فما هي هذه الروابط الكيميائية هو ما سوف يحدثكم عنه موقع المرجع، من خلال تسليط الضوء على أنواع هذه الروابط، على النحو الذي سنتمكن من خلاله من أخذ العلم بـ ما المقصود بالقول ان للماء روابط مشتركة قطبية.
ما المقصود بالقول ان للماء روابط مشتركة قطبية
إن روابط الذرات أو الجزيئات التي تتألف منها المواد، هي من المواضيع المشتركة بين علوم الكيمياء والفيزياء، لكونها تدرس الشوارد والشحنات ضمن الذرات، أما بالنسبة لــ ما المقصود بالقول ان للماء روابط مشتركة قطبية، فإن الإجابة الصحيحة تكون على الشكل التالي:
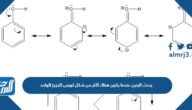
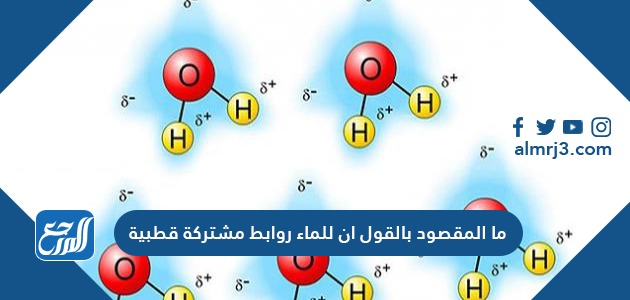
- إن كل ذرة من ذرتي الهيدروجين في تركيبة جزيء الماء لها شحنة موجبة (+1) في أحد طرفيه، في حين أن ذرة الأكسجين لها شحنة سالبة (-2) في الطرف الآخر من الجزيء، ما يعني أن ذرة الماء هي جزيء ذو قطبين، قطب سالب من ناحية ذرة الاكسجين وقطب موجب من ناحية ذرتي الهيدروجين .
هذه الخاصية تجعل جزيئات الماء تنجذب إلى جزيئات الماء الأخرى، سوآءا (من الجهة الإيجابية إلى السلبية أو من الجهة السلبية إلى الإيجابية)، مما يجعل قطرات الماء تتماسك مع بعضها البعض، على النحو الذي نراه في أي شكل من أشكال الماء في البيئة، وكذلك هو الأمر بالنسبة لقطرات الماء على سطح زجاجي ناعم الملمس، فسوف نلاحظ تكتل القطرات على شكل حبيبات على الزجاج نتيجة انجذاب الجزيئات لبعضها البعض.
شاهد أيضاً: تتكون الروابط التساهمية عندما
ما هي الروابط الكيميائية
هي الروابط التي تسعى من خلالها الذرات لتحقيق الاستقرار، حيث أن الذرات تتضمن شحنة موجبة تدعى البروتونات في حين توجد النيوترونات في النواة بدون شحنة، وتدور الإلكترونات السالبة حول غلاف الذرة الخارجي، وتختلف أعداد الإلكترونات السالبة باختلاف العناصر التي تبقى في حالة نشاط ودوران حول الذرة، ولا تستقر الذرات إلا إذا تم تفريغ الشحنة من غلافها الخارجي أو ملئه.
تعتبر مشاركة الإلكترونات واحدة من الطرق المتبعة في تفريغ أو ملء الشحنة من الغلاف الخارجي للذرة، وتسمى هذه الطريقة الروابط التساهمية، في حين توجد طريقة أخرى تتمثل في أن تخسر إحدى الذرات إلكتروناتها، وبالمقابل تكتسب الذرة الأخرى في الرابطة الإلكترونات التي فقدتها الأخيرة، بالتالي تصبح شحنة الذرة التي خسرت إلكتروناتها موجبة، أما التي كسبت إلكترونات فشحنتها سالبة، وهنا تجاذب الأضداد وتسمى هذه الروابط الروابط الأيونية.
شاهد أيضاً: مادة تتكون من اتحاد كيميائي بين عنصرين أو أكثر
الفرق بين الروابط القطبية والروابط غير القطبية
في علم الكيمياء نلاحظ أن الروابط التساهمية بين الذرات، تنقسم إلى روابط قطبية وروابط غير قطبية، وفيما يلي أهم الفوارق بين هذه الروابط:[1]
- توزيع الإلكترونات: في الروابط القطبية توزيع الإلكترونات غير متساوِ بين ذرات المادة، أما في الروابط غير القطبية، فإن الإلكترونات مشتركة بالتساوي بين ذرات المادة، بسبب شدة الجذب المشترك من ناحية العنصر.
- شحنة الجزيء الناجم عن الترابط: في الروابط القطبية الجزيء يحمل شحنة سالبة في أحد طرفيه وشحنة موجبة في طرفه الآخر، على عكس الروابط غير القطبية فإن العنصر يحمل شحنة محايدة إما سالبة أو موجبة.
- تقاسم الإلكترون: في الروابط القطبية فإن الإلكترون لن يتم توزيعه بالتساوي، حيث أن هناك ذرات تأخذ إلكترون في حين الذرات الأخرى تخسر إلكترون، على عكس الروابط القطبية حيث أن الذرات تشترك بالتساوي في نفس الإلكترون.
- تماثل العناصر: في الروابط القطبية العناصر غير متجانسة ومتماثلة، ففي جزيء الماء فهو ناتج عن رابطة قطبية بين ذرتي هيدروجين وذرة ماء، على عكس الروابط غير القطبية التي تتحد فيها ذرتين من نفس العنصر، كأن تتحد ذرتي أوكسجين مثلاً.
- فرق الكهربية: في الروابط القطبية هو (0.5 – 1.7)، في حين أنه في الروابط غير القطبية (0 – 0.4).
شاهد أيضاً: عند اتحاد عنصرين يتكون مركب تختلف صفاته عن صفات العناصر المكونة له
مع هذا القدر من المعلومات نكون قد وصلنا إلى ختام موضوع بحثنا، الذي تحدثنا خلال فقراته عن الروابط الكيميائية التي تربط الذرات ببعضها البعض، واطلعنا على أنواع هذه الروابط، ما مكننا من معرفة ما المقصود بالقول ان للماء روابط مشتركة قطبية، وأيضاً اطلعنا على الفوارق بين الروابط القطبية وغير القطبية.
المراجع
- askanydifference.com , Difference Between Polar and Non-Polar (With Table) , 15/9/2021