قانون يصف العلاقة بين الحجم والضغط بعلاقة عكسية عند ثبوت درجة الحرارة للغاز هو قانون
جدول المحتويات
قانون يصف العلاقة بين الحجم والضغط بعلاقة عكسية عند ثبوت درجة الحرارة للغاز هو قانون، يدرس علم الكيمياء حالات المادة الثلاثة الصلبة، الغازية، السائلة بعد تغيير الظروف الواقعة عليها بالتحكم في العوامل المؤثرة مثل الضغط، درجة الحرارة، عدد جسيمات وغيرها للوصول إلى قوانين تصف حالة الغاز وتطبيقها في حياتنا العملية التي تطورت بسبب تلك الاكتشافات وفي موقع المرجع نقدم لكم قوانين حجم الغاز وأهم العلماء الذين برعوا في تجارب الكيمياء على الحالة الغازية وتعريف قانوني بويل وشارل.
قوانين حجم الغاز الكيميائية
الغاز هو حالة من حالات المادة فهي إما صلبة أو سائلة أو غازية، حسب حركة جزيئاتها التي تملأ الفراغ وقد درس الكثير من العلماء قوانين الغازات ودرسوا وضعها تحت ظروف كيميائية مختلفة مثل تعريض الغاز إلى حرارة وضغط مختلفين وغيرها وقد كان هنالك عدة قوانين درست حجم الغاز ومنها.[1]
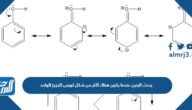
- قانون بويل وهو ض*ح =ثابت.
- شارل ح1 / د1 = ج2 / د2.
- قانون غاي لوساك وهو ض1 / د1 = ض2 /د2.
- الغاز المثالي وقانونه ض ح = ن ث د.
جدير بالذكر أنً ض تمثل الضغط و ح هي حجم الفراغ و ن هي كمية المادة و ث هي ثابت الغاز العام ود هي درجة الحرارة.
قانون يصف العلاقة بين الحجم والضغط بعلاقة عكسية عند ثبوت درجة الحرارة للغاز هو قانون
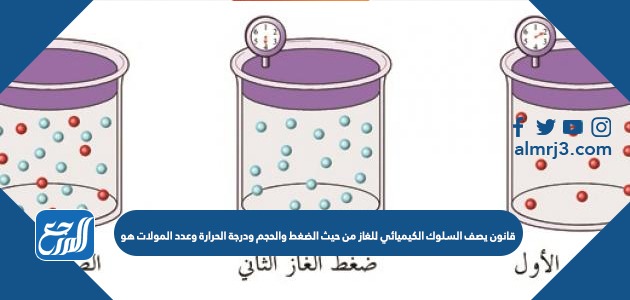
اهتم علماء الفيزياء بحالات المادة الثلاث وخاصة الغازية منها وقد قاموا بتجارب علمية كثيرة تحكموا خلالها في عناصر الضغط ودرجة الجرارة وحجم الحيز لرؤية سلوك الغاز وهل هنالك علاقة تربطها ببعضها حتى ظهر قانون يصِف العلاقة بين الحجمِ والضغطِ بعلاقةٍ عكسيًة عند ثبات درجة حرارة الغاز ومخترعه هو.
- الإجابة الصحيحة: قانون بويل.
شاهد أيضًا: قيمة الرقم الهيدروجيني للقاعدة أقل من 7
قانون بويل وشارل
قوانين الغاز هي قوانين ومبادئ درست العلاقة بين المؤثرات مثل الحرارة والضغط والحجم وعدد جسيمات الغاز في وعاء ما عند تعريضها لعوامل وتثبيت عوامل أخرى تحت ظروف معينة ودراسة العلاقات التي تظهر سواء عكسية أو طردية وقد برع العالمان بويل وشارل في قوانين الغازات كان أبرزها.
- قانون بويل: يصف قانون بويل أن حجم كتلة محددة من الغاز يتناسب عكسي مع كمية الضغط الواقعة عليه عند تثبيت الحرارة، وقد خطها بالقانون الرياضي ض * ح = ثابت.
- قانون شارل: يصف أن حجم كمية محددة من الغاز تتناسب طردي مع درجة الحرارة عند ثبوت الضغط وقد صاغها بالصيغة الرياضية ح1 / د1 = ح2 / د2.
اقرأ أيضًا: اي من المتغيرات الاتيه يعد دليلا على حدوث التفاعل الكيميائي
في ختام مقالنا بعنوان قانون يصف العلاقة بين الحجم والضغط بعلاقة عكسية عند ثبوت درجة الحرارة للغاز هو قانون، وضحنا لكم تفاصيل تجارب الغازات من علماء الكيمياء للوصول إلى قوانين تثبت حجم الغازات.
المراجع
- courses.lumenlearning.com , Boyle’s Law: Volume and Pressure , 21/09/2021