الرابطة الايونية هي التي تحدث بين الفلز واللافلز

جدول المحتويات
الرابطة الايونية هي التي تحدث بين الفلز واللافلز فقد دأب علماء الكيمياء على دراسة الأمور المشتركة بين العناصر الموجودة في الطبيعة ودراستها في حالتها التي تتواجد عليها مع إمكانية ربطها ببعضها لإنتاج مواد جديدة أكثر فائدة لنا عن طريق تجاذب ذرات المواد تماماً كما يحدث في الرابطة الأيونية وأوضح مثال نستخدمه كل يوم يحوي هذه الرابطة هو الملح أو ما يسميه العلماء كلوريد الصوديوم، وفي مقالنا اليوم عبر موقع المرجع سوف نجيب على هذا السؤال المطروح ونتعرف أكثر على ما هي الروابط الكيميائية وأنواعها وكل ما يخص هذا الموضوع.
ما هي الروابط كيميائية
تعرف الروابط الكيميائية على أنها الروابط بين الذرات في الجزيء والتي تربط الذرات معًا، حيث أنه تميل الذرات إلى ترتيب نفسها في أكثر الأنماط استقرارًا مما يعني أنها تميل إلى إكمال أو ملء مداراتها الإلكترونية الخارجية وقد ينضمون إلى ذرات أخرى للقيام بذلك، وتتضمن هذه الروابط كلاً من التفاعلات القوية داخل الجزيئية مثل الروابط التساهمية والأيونية وغيرها، كما أنها تكون مرتبطة بقوى أضعف بين الجزيئات مثل تفاعلات ثنائي القطب وقوى تشتت لندن والرابطة الهيدروجينية.[1]
شاهد أيضًا: ما المقصود بالقول ان للماء روابط مشتركة قطبية
ما هي أنواع الروابط الكيميائية
لقد رأينا أنه يشار إلى القوة التي تربط الذرات معًا في مجموعات تعرف باسم الرابطة الكيميائية وهذه الرابطة لها نوعان رئيسيان وبعض الأنواع الثانوية من الروابط الكيميائية بحسب قوتها ولكن مع ذلك يمكن تصنيفها في الأنواع التالية:[1]
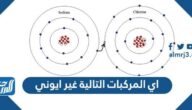
- الرابطة الأيونية: والذي يتضمن نقل الإلكترون بحيث تكتسب ذرة واحدة إلكترونًا بينما تفقد ذرة واحدة إلكترونًا.
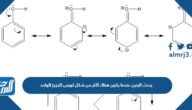
- الرابطة التساهمية: وهي الرابطة الأكثر شيوعًا في الجزيئات العضوية والتي تتضمن مشاركة الإلكترونات بين ذرتين.
- الرابطة القطبية: وهي رابطة وسيطة بين الرابطة الأيونية والتساهمية بحيث يمتلك طرف الجزيء شحنة سالبة والطرف الثاني شحنة موجبة.
- الرابطة الهيدروجينية: وهي من الروابط التي تدخل في العديد من عمليات الحياة حيث أنها تمنح الماء خصائصه الفريدة إضافة إلى تحديد شكل جزيئات الحمض النووي وما إلى ذلك.
الرابطة الايونية هي التي تحدث بين الفلز واللافلز
لقد تعرفنا سابقاً أن الرابطة الأيونية هي عامل جذب بين أيونين يستخدم لإنشاء مركب أيوني جديد حيث تقوم الذرات ذات الاختلافات الكبيرة في الكهربية بنقل الإلكترونات إلى أيونات وفيما بعد تنجذب هذه الأيونات إلى بعضها البعض، مثل ارتباط بين المعدن وغير المعدني، ويتم تمثيل إلكترونات التكافؤ عادةً على أنها تنتقل من ذرة المعدن الفلزي إلى الغير معدني اللافلزي وبمجرد نقل الإلكترونات إلى غير المعدني يعتبر كل من المعدن وغير المعدني أيونات العي سوف تنجذب لتكوين مركب أيوني، ووفق هذه المعطيات التي ذكرناها وبالعودة للسؤال المطروح سنجد أن العبارة المذكورة في نص السؤال هي:[2]
- عبارة صحيحة
شاهد أيضًا: تتكون الروابط التساهمية عندما
خصائص المركبات الأيونية
ترتبط خصائص المركبات الأيونية بمدى قوة جذب الأيونات الموجبة والسالبة لبعضها البعض في رابطة أيونية مشتركة وتتميز بخصائصها التالية:[2]
- تشكل المركبات الأيونية شبكات بلورية بدلاً من مواد صلبة غير متبلورة.
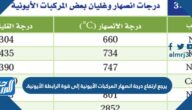
- يلزم درجات حرارة عالية للتغلب على التجاذب بين الأيونات الموجبة والسالبة في المركبات الأيونية لذلك لديهم نقاط انصهار وغليان عالية.
- لديهم محتوى أعلى من المحتوى الحراري للاندماج والتبخر من المركبات الجزيئية.
- البلورات الأيونية تمتلك خاصية الصلابة بسبب قوة التجاذب بين الأيونات الموجبة والسالبة.
- عندما يتم إذابة المركبات الأيونية في الماء فعندها تكون الأيونات المنفصلة حرة في توصيل الشحنات الكهربائية من خلال المحلول.
- على الرغم من أنها تجري في صورة منصهرة أو في محلول مائي فإن المواد الصلبة الأيونية لا توصل الكهرباء جيدًا.
وبهذا القدر نصل إلى نهاية مقالنا الذي كان بعنوان الرابطة الايونية هي التي تحدث بين الفلز واللافلز والذي أجبنا من خلاله على هذا السؤال المطروح وتعرفنا أكثر ما هي الروابط الكيميائية وأنواعها إضافة إلى ذكر خصائص الروابط الأيونية.
المراجع
- courses.lumenlearning.com , Types of Chemical Bonds , 12/10/2021
- britannica.com , Metallic bond , 12/10/2021