رتب كلًا من قوى التجاذب الثنائية القطبية، وقوى التشتت، والروابط الهيدروجينية تصاعديًا حسب قوتها.
جدول المحتويات
رتب كلًا من قوى التجاذب الثنائية القطبية، وقوى التشتت، والروابط الهيدروجينية تصاعديًا حسب قوتها.، تعتبر الذرة أصغر وحدة بناء في المادة، وقد ترتبط ذرتين أو أكثر معًا مشكلة ما يعرف بالجزيء، ويكون الارتباط بواسطة روابط أيونية أو تساهمية، أو قوى ترابط أخرى، ومن خلال موقع المرجع سنتعرفُ على الجزيء، وقوة الروابط بين ذرات الجزيء بشكل تصاعدي.
مفهوم الجزيئات
تنتج الجزيئات عند ارتباط أكثر من ذرة مع بعضها البعض، حيث أن الذرة المنفردة لا تعتبر جزيء، مثل ذرة الأكسجين، لكن عند ارتباطها بالماء فإنه يصبح جزيء الماء ويرمز له بالرمز الكيميائي H₂O، ويعتبر الجزيء أبسط وأصغر وحدة للمركبات الكيميائية والتي تتكون من ذرّتين أو أكثر، حيث ترتبط الذرات مع بعضها البعض من خلال القوى الكيميائية التي تنشأ بينهم والتي تؤدي إلى تكوين الروابط الكيميائية الناتجة من مشاركة الإلكترونات أو تبادلها بين الذرات.[1]
شاهد أيضًا: الروابط الأيونية تنشأ بين الذرات التي تتشارك بالإلكترونات
رتب كلًا من قوى التجاذب الثنائية القطبية، وقوى التشتت، والروابط الهيدروجينية تصاعديًا حسب قوتها.
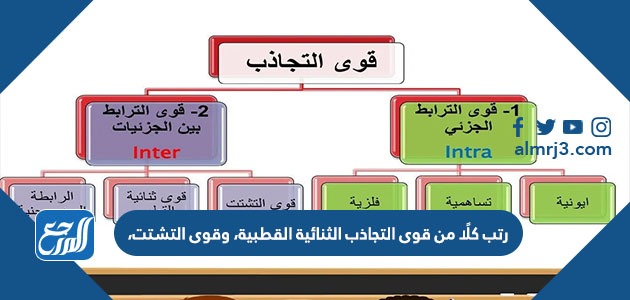
يعتبر الجزىء أصغر وحدة في المادة الكيميائية، ويتكون الجزيء من مجموعة من الذرات تصل إلى ذرتين أو أكثر ترتبط معًا بواسطة روابط كيميائية، فتكون روابط أيونية أو روابط تساهمية، بالإضافة إلى قوى ترابط أخرى تجمع الجزيئات مع بعضها وهي قوى التجاذب بين الجزيئات ثنائية القطب، وقوى التجاذب بين الجزئيات غير القطبية بالإضافة إلى الروابط الهيدروجينية، وفيما يأتي ترتيب هذه الروابط الكيميائية بشكل تصاعدي حسب قوة ارتباط الذرات ببعضها:
- الرابطة الهيدروجينية، قوى التجاذب الثنائية القطبية، قوى التشتت.
وهذه الروابط جميعها تنشأ لوصول الذرات في أي جزيء لحالة الاستقرار، وتشبع مدارها الأخير بالإلكترونات.
شاهد أيضًا: تبين الصيغ الكيميائية نوع الروابط وعددها في الجزئ
الروابط الكيميائية في الجزيئات
تنتج الروابط الكيميائية في الجزيئات من خلال مشاركة الالكترونات عن طريق الكسب أو الفقد في المدار الأخير للذرات المكونة للجزيء، وفيما يأتي ذكر لأنواع الروابط الكيميائية في الجزيئات:
- الروابط الأيونية: تنشأ هذه الروابط في الجزيئات نتيجة لفقد إلكترون أو أكثر من إلكترونات المدار الأخير للذرة فينشأ عنه جسيم موجب الشحنة، أو كسب إلكترون أو أكثر من إلكترونات المدار الأخير فينشأ عنه جسيم سالب الشحنة، وهذه الشحنات نتجت نتيجة الاختلاف اختلاف عدد الإلكترونات والبروتونات فيها، مثل: جزي كلوريد الصوديوم (NaCl).
- الروابط التساهمية: تنشأ هذه الروابط في الجزيئات نتيجة لتشارك الكترونات المدار الأخير للذرات المكونة للجزيء، وتعتمد قوة الرابطة التساهمية على عدد الالكترونات المشاركة، فكلما زاد عدد الالكترونات زادت قوة الرابطة، ومن الأمثلة عليها جزيء الميثان (CH₄).
- الرابطة الهيدروجينية: تعتبر من الروابط الكيميائية الضعيفة، والتي تنتج عن ارتباط ذرة الهيدروجين مع أي ذرة أخرى برابطة تساهمية.
إلى هنا نكون قد وصلنا إلى نهاية مقالنا رتب كلًا من قوى التجاذب الثنائية القطبية، وقوى التشتت، والروابط الهيدروجينية تصاعديًا حسب قوتها.، حيث سلطنا الضوء على تعريف الجزيء، وأنواع الروابط بين ذراته.
المراجع
- techtarget.com , molecule , 13/09/2022