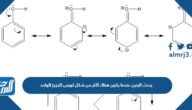
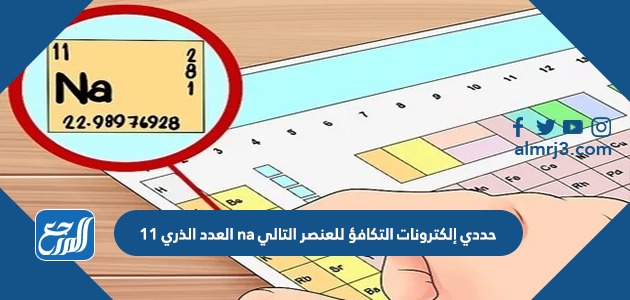
حددي إلكترونات التكافؤ للعنصر التالي na العدد الذري 11
جدول المحتويات
حددي إلكترونات التكافؤ للعنصر التالي na العدد الذري 11، حيث يُعتبر عنصر الصوديوم من أهم العناصر الموجودة في الجدول الدوري، والتي تدخل في العديد من التفاعلات الكيميائية كما أن له أهمية اقتصادية كبيرة، ومن خلال موقع المرجع إليكم إلكترونات تكافؤ عنصر الصوديوم (na) وخصائصه المميزة.
عنصر الصوديوم
عنصر الصوديوم الذي يأخذ الرمز الكيميائي Na هو من أكثر العناصر الكيميائية انتشارًا على الكرة الأرضية حيث أن ترتيبه السادس، ويقع الصوديوم في المجموعة الأولى في الجدول الدوري وهذا ما يجعله من الفلزات القلوية التي تشارك في العديد من التفاعلات الكيميائية، والجدير بالذكر أنه من الصعب الحصول على عنصر الصوديوم نقي في الطبيعة بل يوجد على هيئة مركبات كيميائية من أشهرها مركب كلوريد الصوديوم (NaCL) والذي يشتهر باسم ملح الطعام، ويعرف الصوديوم بقوة تفاعله مع الماء والهواء الجوي حيث يتفاعل بفرقة، ولهذا يحفظ عادة تحت سطح الكيروسين.
عرف عنصر الصوديوم وتم اكتشافه في أوائل القرن التاسع عشر، حيث تم اكتشافه على يد العالم همفري ديفي لأول مرة في شكل حر، وذلك نتيجة التحليل الكيميائي لمادة هيدوركسيد الصوديوم.[1]
اقرأ أيضًا: ما هو المركب الذي يشوه الفلز
حددي إلكترونات التكافؤ للعنصر التالي na العدد الذري 11
- إنّ إلكترونات التكافؤ للعنصر Na العدد الذري 11 هو إلكترون واحد.
حيث يتم توزيع العدد الذري لهذا العنصر على 3 مستويات طاقة بحيث يبقى في المستوى الأخير عنصر واحد فقط، ولهذا يرمز لتكافؤ عنصر الصوديوم بـ +1، وهذا يشير إلى أن ذرة العنصر تميل خلال التفاعل الكيميائي إلى فقد إلكترون مستوى الطاقة الأخير، وذلك لكي تكون كاتيون موجب هو Na+، ولهذا يظهر عنصر الصوديوم في المركبات الأيونية مثل مركب كلوريد الصوديوم، والجدير بالذكر أن فقدان الصوديوم إلكترون مستوى الطاقة الأخير يجعله يتشابه في العدد الذري مع الغاز الخامل النيون وهو الذي يسبقه في الجدول الدوري.
أهم خواص الصوديوم
يقع عنصر الصوديوم في المجموعة الأولى والدورة الثالثة في الجدول الدوري، وهذا الموقع المميز يجعله من الفلزات القوية، ويتميز ببعض الخصائص المهمة وهي كالآتي:
- قابل للطرق والسحب.
- جيد لتوصيل الحرارة والكهرباء.
- لونه أبيض فضي.
- يتميز بشكل شمعي.
- شديد التفاعل.
- يعطي أملاح أيونية عند تفاعله مع الهالوجينات مثل الكلور.
- قابل للاحتراق عند تعرضه لأكسجين الهواء الجوي ويكون أكسيد الصوديوم.
ما هي استخدامات الصوديوم
يتميز عنصر الصوديوم بسهولة دخوله في التفاعلات الكيميائية حيث يميل وبشدة إلى فقد إلكترون التكافؤ الأخير، وهذا ما يجعل له العديد من الاستخدامات المختلفة، ومن ضمنها الآتي:
- يستخدم كمبرد في المفاعلات النووية وسريعة التوليد، وذلك بسبب قدرته على نقل الحرارة.
- يدخل في العديد من المركبات العضوية إلى جانب صناعة العطور والأصباغ.
- يدخل في صناعة مركب كبريتات الكيل الصوديوم وهي أهم العناصر الموجودة في المنظفات الصناعية.
- يدخل في صناعة البنزين من خلال مركب رباعي إيثيل الرصاص.
اقرأ أيضًا: تتكون الروابط التساهمية عندما
الصوديوم في جسم الإنسان
يعتبر عنصر الصوديوم من أهم العناصر الموجودة في جسم الإنسان والتي تساعد على ضبط ضغط الدم ومساعدة الكلى في عملها إلى جانب تعزيز وصول الشحنات الكهربائية في الجهاز العصبي، ولهذا من الضروري أن يحصل الفرد على القدر الكافي من الصوديوم يَوْمِيًّا لتجنب ارتفاع ضغط الدم والإصابة بالجلطات الدماغية، وقد أثبتت الدراسات العلمية أن الشخص البالغ يحتاج إلى 1500 ملليجرام من الصوديوم بشكل يومي، وهو ما يمكن الحصول عليه من الأطعمة المصنعة.
بهذا نكون قد تعرفنا خلال هذا المقال على إجابة سؤال حددي إلكترونات التكافؤ للعنصر التالي na العدد الذري 11، إلى جانب الإشارة إلى أهم ما يخص هذا العنصر الفلزي.
المراجع
- ar.wikipedia.org , الصوديوم , 11/9/2021