فسر العلاقة بين التدرج في نصف قطر الذرة
جدول المحتويات
فسر العلاقة بين التدرج في نصف قطر الذرة، علوم الكيمياء واحدة من العلوم التي رسخت قوانين تكون الكون من ولنا من ذرات وعناصر ومركبات مع إظهار التركيب الداخلي للعدد الذري والكتلي لكل عناصر المجموعات والدورات الكيميائية، وقد انطلقت الكمياء بعد اكتشاف الذرة ومكوناتها داخل النواة، لذلك من المهم دراسة الكيمياء كأهم العلوم المدرسية التعليمية التي توسع أفق الطلبة في المملكة العربية السعودية وتزيد ثقافة تعلم اسماء العناصر وحل المعادلات الكيميائية وسنوضح في موقع المرجع تعريف الجدول الدوري، والفرق بين الدورة والمجموعة في الجدول بالإضافة إلى تفسير إجابة السؤال المطروح.
ما هو الجدول الدوري الكيميائي
يُعرف الجدول الدوري بأنه تصنيف يٌرتب جدولة العناصر الكيميائية مع تنظيم التوزيع الإلكتروني للعناصر وعددها الذري وتوضيح المجموعات ذات الصفات المشتركة والدورات وقد اخترعه العالم ماندليف، وهنالك عدة مجموعات في الجدول الدورة مثل:
- مجموعة الفلزات.
- اللافلزات.
- مجموعة العناصر النبيلة “الهالوجينات”.
شاهد أيضًا: تسمى الجزيئات التي تمتلك توزيعًا مماثلاً للشحنات الموجبة والسالبة
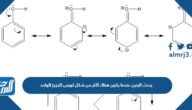
فسر العلاقة بين التدرج في نصف قطر الذرة
لا تتساوى أحجام نصف قطر الذرة في كل دورات ومجموعات عناصر الجدول الدوري التي أظهرت التوزيع الالكتروني، بل تتدرج أنصاف أقطار الذرات وذلك حسب علاقة شرحت سبب التدرج كما وضح الكيميائيين والإجابة الصحيحة هي:[1]
- علاقة عكسية تربط التدرج في نصف قطر الذرة، إذ كلما زاد نصف قطر الذرات عند التحرك من أعلى المجموعة إلى أسفلها وسبب ذلك زيادة إلكترونات مستوى الطاقة الأخير ما يجعل الالكترونات الداخلية تعيق الكترونات التكافؤ وتحجبها عن شحنة النواة التي تزداد، على جهة أخرى ينقص نصف قطر الذرات في الدورات وذلك بسبب زيادة شحنة النواة الموجبة فيؤدي لعدم قدرة الالكترونات الداخلية حجب الكترونات التكافؤ فتصبح أقرب للنواة.
اقرأ أيضًا: اي من المتغيرات الاتيه يعد دليلا على حدوث التفاعل الكيميائي
تعريف الدورة والمجموعة في الجدول الدوري
في علم الكيمياء تبدأ الاكتشافات من الذرة ومكوناتها الثلاثة البروتونات والنيترونات والإلكترونات التي تسبح في مدارات ومستويات طاقة موزعة عليها ذرات العناصر التي يتنوع ذكر أسماءها في الجدول الدوري الذي شرح الاسم والتوزيع الالكتروني، ويتكون هذا الجدول من 18 عمود تسمى مجموعات، و7 صفوف تسمى دورات وتعريفها:
- الدورة: هي صفوف الجدول الدوري التي تشير إلى زيادة ك.ذ لكل عنصر عند التحرك من الشمال إلى اليمين.
- المجموعة: هي أعمدة الدول الدوري يحث تجمع العناصر ذات الصفات المشتركة في مجموعة واحدة مثل مجموعة الفلزات واللافلزات والمجموعة السابعة الهالوجينات أو العناصر النبيلة، والمجموعة فيها عدد الالكترونات متساوي في المدار النهائي، وكلما ارتفعنا من فوق لتحت المجموعة يزيد نصف قطر الذرة، تنقص طاقة التأين، تتقلص الكهروسالبية.
في ختام مقالنا بعنوان فسر العلاقة بين التدرج في نصف قطر الذرة، وضحنا لكم أحبتنا تعريف الدورة والمجموعة في الجدول الدوري المتخصص في التوزيع الالكتروني وتفسير سبب التدرج في نق الذرات.