الرابطه الايونيه عبارة عن فقد واكتساب الالكترونات
جدول المحتويات
الرابطه الايونيه عبارة عن فقد واكتساب الالكترونات، يرجعُ وجود الروابط الكيميائيّة في الجزيء أو البلورة أو غيرُ ذلكَ إلى تفاعلِ الإلكترونات الموجودة في الذرّة، وهذا الإلكترون جزء من المدار الذري للذرة، وتفاعلات الإلكترونات تنشأ نتيجة القوة الكهرومغناطيسية، حيثُ تتأثرَ الإلكترونات سالبّة الشحنة بنواة الذرة موجبة الشحنة، ومن خلال موقع المرجع سنخصصُ الحديثَ عن الرابطة الأيونية، وتكون الرابطة الأيونية.
الرابطه الايونيه عبارة عن فقد واكتساب الالكترونات
ما مدى صحة العبارة، الرابطة الأيونية عبارة عن فقد واكتساب الالكترونات ؟
- العبارة صحيحة.
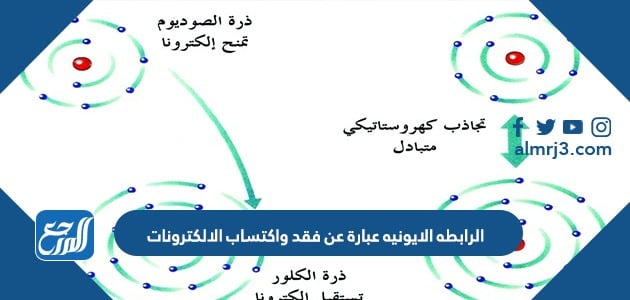
فالرابطةُ الأيونية تتكونُ في المركباتِ الكيميائيّة، بسبب قوة الجذبِ الكهربائي بين الأيوناتِ مُختلفة الشُحنّة، حيثُ تفقدُ أحدُ الذرات المُشارِكة إلكترونًا، لتصبحَ ذات أيونًا مُوجبًا، وتكسبُ الذرة الأخرى هذا الإلكترون، وتكونُ أيونًا سالبًا، ويوجدُ هنالك اختلاف في نسبةِ الأيونات المفقودة والمكتسبة فمثلاً تحتاج ذرة الأكسجين لأيونين من البوتاسيوم لأنّ المدار الأخير يحتاج لإلكترونين ليصل لحالة الاستقرار أي ثمانية إلكترونات، وتتكونُ هذه الرابطة عادةً ما بينَ اللافلزات، والفلزات القلوية، والقلوية الترابية، حيثُ أنّ الفلزات تكونُ ذاتَ طاقة تأيّن مُنخفضة بحيثُ تميل لفقدِ الإلكترونات، واللافلزات ذات الأُلفة الالكترونية المرتفعة التي تميلُ لاكتسابِ الإلكترونات، ويتكونُ ما يُعرفُ بالمركباتِ الأيونيّة.
شاهد أيضًا: ما المقصود بالقول ان للماء روابط مشتركة قطبية
تكون الرابطة الأيونية
تتكونُ الرابطة الأيونيّة في المركبات الكيميائيّة بينَ الأيوناتِ مُختلفة الشحنّة، حيثُ أنّه يوجدُ هنالك نوعانِ من الأيوناتِ وهي: الأيونات المُوجبّة، والأيونات السالبّة، والأيونات الموجبّة هي الأيوناتِ التي تتكونُ نتيجةً لفقدِ الإلكترونات، فقدْ تفقدُ الذرّة إلكترونًا أو أكثر لتصبحَ أيونًا مُوجبًا، أما الأيونات السالبّة فهيّ مُعاكسة للأيونات المُوجبة، حيثُ أنّها تتكونُ نتيجة لاكتسابِها للإلكترونات، حيثُ أنّ العناصرِ اللافلزية تكتسبُ الإلكتروناتِ بدلاً من فقدانِها، فتتكونُ المُركبات الأيونيّة نتيجة عملية فقد وكسب الإلكترونات بينَ الأيون المُوجب والأيون السالب للعناصر والتي ينشأ منّها رابطة أيونيّة، وغالبًا ما يتمُّ تكوين الرابطة الأيونية بينَ العناصر الفلزية التي تميلُ لفقدِ الإلكترونات منْ أجلِ إشباعِ إلكتروناتِها الثمانيّة في مدارِها الأخير، والعناصر اللافلزيّة التي تميلُ لاكتسابِ الإلكترونات، من أجل إشباع إلكتروناتِها الثمانيّة في مدراِها الأخير، وبالتالي تصلُ العناصر إلى مرحلة الاستقرار، وفي كتابةِ صيغِ المُركبات الأيونية، فإنّ الجزء الأول يكونُ هو الأيون المُوجب الذي يُدعى الكاتيون، والجزء الثاني هو الأيون السالب الذي يُدعى الأنيون، ويجبُّ أن تكون القيمة النهائيّة للمركب الأيوني صفرًا، لتكون جزيء مُتعادل كهربائيًا ومُستقر. [1]
شاهد أيضًا: الرابطة الايونية هي التي تحدث بين الفلز واللافلز
خصائص المركبات الأيونية
يوجدُ عدّة خصائص للمركبات الأيونية، ومنّها:
- تعتبرُ المركبات الأيونيّة عوازل جيّدة في حالتِها الصلبّة، حيثُ أنّها غيرُ موصلة للتيارِ الكهربي في الحالة الصلبّة.
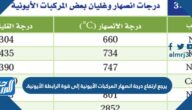
- تكونُ حرارة الانصهار والتبخير للمركبات الأيونيّة أعلى من المركبات الجزيئية، حيثُ أنّ مُحتواها الحراري يكونُ أعلى عشر مرات أو أكثر من المركبات الجزيئية.
- طبيعة بلورات المركبات الأيونيّة صلبة وهشّة، وذلكَ نتيجة لقوى التجاذبِ بين الأيونات المُوجبّة والسالبّة مع بعضِها.
- تتشكلُ شبكة من البلوراتِ من المركبات الأيونيّة.
- تكونُ درجاتِ الانصهارِ والغليانِ مُرتفعة جدًا بين المُركبات الأيونية، وذلكَ للتغلب على قوى التجاذبِ بين الأيونات الموجبة والسالبة فيها.
إلى هُنا نكون قد وصلنا إلى نهايةِ مقالنا الرابطه الايونيه عبارة عن فقد واكتساب الالكترونات، حيثُ سلطنا الضوءَ على كيفية تكون الرابطة الأيونيّة بين ذرات العناصر المُختلفة، وخصائص المركبات الأيونيّة المُختلفة.
المراجع
- britannica.com , ionic bond , 11/12/2021