أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو

جدول المحتويات
أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو أحد المواضيع العلمية المطروحة ضمن المناهج التدريسية، والتي تركز على إحاطة الطالب علماً بالمقصود بالطاقة الإلكترونية في الذرة، والضوابط التي تحكم تلك الطاقة من حيث القوة أو الانخفاض، وانطلاقاً من هذه المعطيات سوف يتيح لكم موقع المرجع، فرصة التعرف على الطاقة الإلكترونية في الذرة، وآلية حساب مستويات هذه الطاقة وحجمها الأقصى في كل مستوى على حدا.
التوزيع الإلكتروني للعناصر
إنّ كل ذرة من الممكن أن تمتلك إلكترونات سالبة الشحنة أو بروتونات موجبة الشحنة، كما يمتلك كل إلكترون ضمن الذرة نوع من الطاقة يقوم مبدأه على العلاقة بين الإلكترون سالب الشحنة والنواة الموجبة الشحنة من جهة، ومن جهةٍ أخرى على علاقته بالإلكترونات سالبة الشحنة الأخرى ضمن الذرة الواحدة، ويمكن لهذه الطاقة أن تختلف في الذرة الواحدة زيادةً أو نقصاناً بحسب عدد تلك الإلكترونات، وقد أوجد علماء الكيمياء طريقة سهلة لحساب عدد تلك الإلكترونات في الذرة من خلال تقسيم الذرة إلى عدة مستويات للطاقة، بحسب بعد الإلكترون عن مركز الذرة “النواة موجبة الشحنة”، وبالتالي فإن اختلاف عدد تلك الإلكترونات في كل مستوى سيؤدي إلى اختلاف حجم الطاقة.
شاهد أيضًا: العدد الكتلي يساوي مجموع عدد البروتونات وعدد الالكترونات في نواة الذرة
أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو
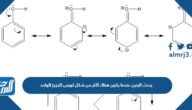
مستويات الطاقة الرئيسية في الذرة مقسمة بأرقام، من 1 – 7 مستويات، كل مستوى له حد أعلى من الإلكترونات يمكن أن يستوعبه في مستوى الطاقة الرئيسي، وعليه تكون الإجابة الصحيحة عن السؤال التالي:[1]
أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو 18.
المستوى الأول دائماً يبدأ بإلكترونيين، ويحسب الحد الأقصى له بأن نضرب رقم المستوى بنفسه بحسب عدد الإلكترونات والناتج يضرب مرة أخرى بعدد الإلكترونات الأدنى في المستوى الأول، وعليه لمعرفة عدد الإلكترونات في المستوى الثالث للطاقة نضرب رقم المستوى وهو ثلاثة بنفسه بحسب عدد الإلكترونات الأدنى في المستوى الأول أي مرتين، ثم تضرب الناتج بعدد الإلكترونات الأدنى وهو إلكترونين، أي أن عدد الإلكترونات الأقصى في المستوى الثالث = 2 × (3²) = 3 × 3 × 2 = 18.
شاهد أيضًا: إمكانية تحرير إلكترونات معدن بواسطة شعاع ضوئي مناسب تعرف بظاهرة
عدد الإلكترونات في مستويات الطاقة الرئيسية
يمكن حساب عدد الإلكترونات في مستويات الطاقة الرئيسية، بموجب المعطيات التالية:
- تقع الإلكترونات في الذرة ضمن مدارات حول النواة تسمى “مستويات الطاقة”.
- قسم العلماء تلك المستويات إلى سبعة مستويات رئيسية تقابلها مستويات فرعية.
- يطلق على الأقرب إلى النواة اسم المستوى الأول للطاقة، ثم يليه الثاني فالثالث فالرابع وهكذا، بحيث يبتعد كل واحد عن الذي يسبقه ويليه قليلاً.
- يستوعب كل مستوى حده الأقصى من الإلكترونات، أما الفائض فينتقل للمستوى الذي يليه.
- عندما يحتوي مستوى الطاقة الأول على إلكترونين، تنتقل الإلكترونات التالية إلى مستوى الطاقة الثاني حتى يحتوي المستوى الثاني على 8 إلكترونات.
- يطلق على الإلكترونات المتواجدة في مستوى الطاقة الأبعد عن مركز الذرة “النواة” إلكترونات التكافؤ.
- في الجدول الدوري، تحتوي جميع الذرات الموجودة في نفس العمود (المجموعة)، نفس عدد إلكترونات التكافؤ في المستوى الإلكتروني الأبعد.
شاهد أيضًا: تتشارك ذرتا كلور في زوج من الإلكترونات لتكونا رابطة؟
وبهذا القدر من المعلومات نكون قد وصلنا وإياكم إلى نهاية فقرات هذا المقال المطروح بين أيديكم، والذي كان بعنوان أكبر عدد من الإلكترونات في مستوى الطاقة الرئيسي الثالث هو، فقد تعرفنا من خلال سطوره على مفهوم الطاقة الإلكترونية ومستويات الطاقة في الذرة، كما تعرفنا على الآلية التي حددها العلماء لحساب الحد الأقصى للإلكترونات في كل مستوى.
المراجع
- archives.library.illinois.edu , An Atomic Model , 09/11/2021