خريطة مفاهيم الروابط الكيميائية
جدول المحتويات
ما هي الروابط الكيميائية
الروابط الكيميائية هي القوة التي تربط الذرات مع بعضها البعض وفق مجموعاتٍ تُعرف باسم الرابطة الكيميائية. ويمكن تصنيف الترابط الكيميائي على أنّه أحد أساسيات الكيمياء التي تشرح مفاهيم أخرى مثل الجزيئات والتفاعلات، والتي بدونها سيشعر العلماء بالعجز عن تفسير سبب انجذاب الذرات لبعضها البعض أو كيفية تكوين النواتج بعد حدوث تفاعل كيميائي.
شاهد أيضًا: تبين الصيغ الكيميائية نوع الروابط وعددها في الجزئ
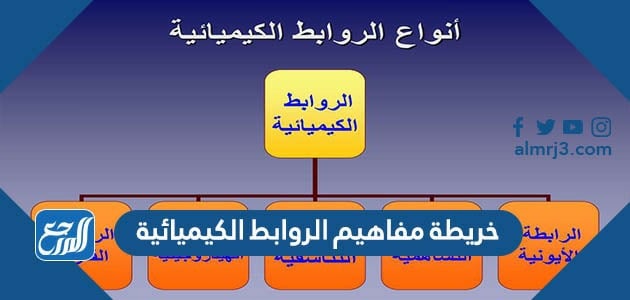
خريطة مفاهيم الروابط الكيميائية
تعرف الذرات المفردة بأنّها بحاجة دائمة إلى الاستقرار، لذلك تبحث دائمًا عن روابط كيميائية مع ذرات أخرى من أجل تحقيق هذا الثبات والاستقرار، وتختلف طريقة حصولها على استقرارها باختلاف الذرة التي سترتبط معها، فإمّا أن تكون هذه الروابط تساهمية (حيث تساهم وتشارك كل ذرة بعدد من الإلكترونات وفقًا لاحتياجات كل ذرة)، أو روابط أيونية من خلال الفقد أو الأخذ. وسنرود فيما يلي خريطة مفاهيم الروابط الكيميائية.
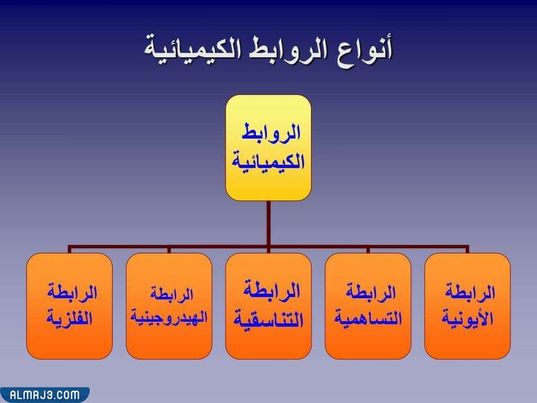
أنواع الروابط الكيميائية
هناك العديد من الروابط الكيميائية تختلف باختلاف حاجة الذرات للإلكترونات، وهذه الأنواع هي:[1]
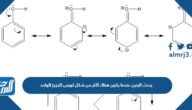
- الروابط الأيونية: تدلّ الرابطة الأيونية على الرابطة التي يشمل عملية نقل الإلكترونات من ذرة إلى أخرى، بحيث تكتسب ذرة واحدة إلكترونًا، بينما تفقد الذرة الأخرى إلكترونًا واحدًا. بحيث يحمل أحد الأيونات الناتجة شحنة سالبة، والأيون الآخر يحمل شحنة موجبة، وذلك وفق القاعدة الشحنات المتعاكسة تتجاذب.
- الروابط التساهمية: تعتبر أكثر الروابط شيوعًا بين الذّرات، وهي عبارة عن الروابط التي تساهم مع بعضها البعض في تكوين وتشكيل جزيء، وتنقسم الروابط التساهمية إلى نوعين هما الرابطة التساهمية القطبية والرابطة التساهمية غير القطبية أو ما تسمى بالرابطة الهيدروجينية.
- الرابطة التناسقية: وهي حالة وسط بين الترابط الأيوني والترابط التساهمي، حيث يكون أحد طرفي الجزيء مشحونًا سالبًا، والطرف الآخر مشحون بشحنة إيجابية. وتدعى أيضًا بالرابطة التساهمية أو التساندية. وتنشأ هذه الرابطة بين الذرات لتكوين الجزيئات، أو بين ذرة في جزيء وأيون أو ذرة في جزيء وذرة في جزيء آخر.
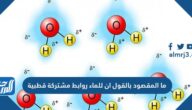
- الرابطة الهيدروجينية: تعتبر هذه الرابطة أضعف نوع في أنواع الروابط الكيميائية، وهو تفاعل يتضمن ذرة هيدروجين تقع بين زوج من الذرات الأخرى التي لها انجذاب كبير للإلكترونات. وفي بعض الأحيان توجد هذه الرابطة بين الذرات في جزيئات مختلفة أو في أجزاء من نفس الجزيء.
- الروابط الفلزية: هي القوة التي تربط الذرات مع بعضها البعض في المادة المعدنية. وتتكون هذه المادة الصلبة من ذرات متماسكة بشكلٍ وثيق. وفي الروابط الفلزية يتداخل الغلاف الإلكتروني الخارجي لكل ذرة من الذرات المعدنية مع عدد كبير من الذرات المجاورة، مما يتسبب في تحرك إلكترونات التكافؤ باستمرار من ذرة إلى أخرى ولا ترتبط بأي زوج محدد من الذرات. ويمكن وصفها أنّها على عكس الروابط الموجودة في المواد المترابطة تساهميًا، فهي غير ساكنة، ولها القدرة على التحرك بحرية نسبيًا في جميع أنحاء البلورة بأكملها.
المراجع
- depts.washington.edu , Atomic Bonding , 13/02/2022