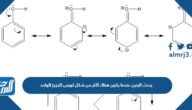
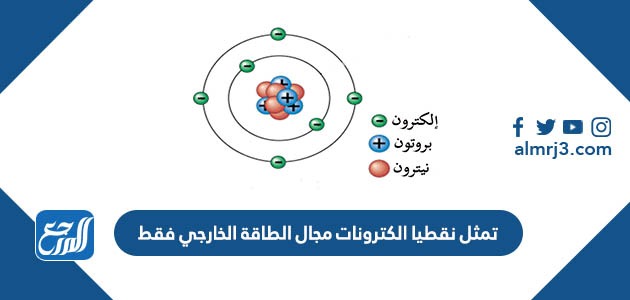
تمثل نقطيا الكترونات مجال الطاقة الخارجي فقط
جدول المحتويات
تمثل نقطيا الكترونات مجال الطاقة الخارجي فقط، تكمن أهمية الجدول الدوري في تنظيمه لكافّة العناصر الكيميائية المتواجدة في الطبيعة، ويعتبر العالم الروسي ديمتري مندلييف أوّل كيميائي يقوم بنشر نسخة للجدول الدوري في عام 1834 م، فقام بتنظيم العناصر في أعمدة وصفوف ومجموعات بحيث يكون لكل عامود أو مجموعة خواص معينة مشتركة، وللاستفادة بمزيد من المعلومات سنتعرف في موقع المرجع على الالكترونات، وكل ما يتعلق بها.
الجدول الدوري
يُسمّى الجدول الدوري في اللغة الإنكليزية (periodic table)، وهو عبارة عن ترتيب وتنظيم لجميع العناصر الكيميائية تبعاً لعددها الذري وخواصها الكيميائية، ويبلغ عدد العناصر المعروفة 118 عنصراً، ومهمّة الجدول الدوري هي تنسيق هذه العناصر ضمن أعمدة وصفوف، فقد قام العالم ديمتري مندلييف بتنسيق العناصر حسب أوزانها الذرية (أي الكتل المولية) وعندما تمّ ترتيبها بهذا الشكل، ظهرت خواص كيميائية متشابهة بين العناصر، كما أن الجدول الذي أوجده مندلييف كان بمقدوره التنبؤ بعناصر لم يتم إيجادها أو اكتشافها بعد في تلك الحقبة الزمنية.[1]
شاهد أيضًا: السحابة الالكترونية هي المنطقة التي تتحرك فيها الالكترونات حول النواة
تمثل نقطيا الكترونات مجال الطاقة الخارجي فقط
إنّ مصطلح الكترون التكافؤ سواءً في الفيزياء أو الكيمياء يشير إلى الكترون مرتبط بذرة ومتواجد في الغلاف الخارجي، ويمكن لهذا الالكترون أن يقوم بالمشاركة لتأسيس رابطة كيميائية (أي رابطة تساهمية) وذلك بحال وجد الغلاف الخارجي غير مغلق، ودوماً ما نجد بأن العناصر الرئيسة تتواجد إلكترونات التكافؤ فيها على الغلاف الخارجي فقط، ومن سياق ذلك نستنتج بأن العبارة تمثل نقطيا الكترونات مجال الطاقة الخارجي فقط:
- عبارة صحيحة
شاهد أيضًا: العدد الكتلي يساوي مجموع عدد البروتونات وعدد الالكترونات في نواة الذرة
مجموعات الجدول الدوري
تتواجد المجموعات بشكل أعمدة رأسية مرتبة من 1 إلى 18، حيث تتمتع كافة العناصر المتواجدة في نفس المجموعة بخصائص متشابهة، وهذا يعود إلى عدد الإلكترونات الموجودة على الغلاف الخارجي لكل ذرة (أي الكترونات التكافؤ)، وسنقوم فيما يأتي بذكر العناصر الكيميائية في الجدول الدوري تبعاً لمجموعاتها:[2]
- المجموعة الأولى: أو المجموعة 1A، حيث تتضمن كلاً من الفلزات القوية والهيدروجين، وتحوي هذه المجموعة على الكترون فقط في غلافها الخارجي.
- المجموعة الثانية: أو المجموعة 2A، وتتضمن الفلزات التفاعلية الترابية، والتي تتميز بألوان جميلة عند الاشتعال، كما تحوي هذه المجموعة الكترونين في الغلاف الخارجي.
- المجموعة الثالثة: أو المجموعة 3A، والتي تتضمن فلزات بالإضافة إلى البورن، إذ يعتبر شبه فلز، وتحوي 3 الكترونات في الغلاف الخارجي.
- المجموعة الرابعة: أو المجموعة 4A، تتضمن كلاً من الفلزات واللا فزات وأشباه الفلزات، كما يحتوي السيليكون والكربون على 4 الكترونات في الغلاف الخارجي.
- المجموعة الخامسة: أو المجموعة 5A، والتي تتضمن الفلزات، اللا فلزات وأشباه الفلزات، كما يحوي الفوسفور والنتروجين على 5 الكترونات في الغلاف الخارجي.
- المجموعة السادسة: أو المجموعة 6A، تتضمن الفلزات واللا فلزات وأشباه
- الفلزات، ويحوي الكبريت والأكسجين على 6 الكترونات تكافؤية.
- المجموعة السابعة: أو المجموعة 7A، تتضمن اللافلزات التي تكون شديدة التفاعل، وتحوي جميع عناصرها على 7 الكترونات تكافؤية.
- المجموعة الثامنة: أو المجموعة 8A، تُعرف بمجموعة الغازات النبيلة، وتحتوي كل عناصرها على غلاف خارجي إلكتروني مكتمل.
في النهاية، نصل إلى ختام موضوعنا الشيّق الذي تعرفنا فيه على مدى صحة العبارة تمثل نقطيا الكترونات مجال الطاقة الخارجي فقط، كما ذكرنا فيه لمحة عن الجدول الدوري ومجموعاته مع شرح مبسط لكلٍ منها.
المراجع
- livescience.com , Periodic Table of Elements , 28/01/2022
- chemistrytalk.org , How to Read the Periodic Table , 28/01/2022