بحث عن التوزيع الإلكتروني doc
جدول المحتويات
- 1 مقدمة بحث عن التوزيع الإلكتروني
- 2 بحث عن التوزيع الإلكتروني
- 3 خاتمة بحث عن التوزيع الإلكتروني
- 4 بحث عن التوزيع الإلكتروني doc
- 5 بحث عن التوزيع الإلكتروني pdf
- 6 المراجع
بحث عن التوزيع الإلكتروني doc، الذرةُ هيّ أصغر جسيم في المادة، وهيّ المكون الأساسي لكل عنصر موجود في الجدولِ الدوريّ، والذرة في ماهيتها المتناهيّة في الصغر تتكونُ من مجموعات مُختلفة من البروتونات موجبّة الشحنة، والإلكترونات سالبة الشحنة، والنيوترونات متعادلة الشحنة، ومن خلال موقع المرجع سندرجُ بحثًا متكاملاً عن التوزيع الإلكتروني لعناصر الجدول الدوري.
مقدمة بحث عن التوزيع الإلكتروني
تتكونُ جميع المواد في الطبيّعة من الذرات، وتتكونُ الذرة من ثلاثّة أجزاء رئيسيّة، وهيّ بروتونات ونيوترونات وإلكترونات، إذْ أن البروتونات تحملُ شحنة موجبة، والنيوترونات متعادلةَ الشُحنة، ومعًا يشكل كلاً من البروتونات والنيوترونات نواة الذرّة، أما حول النواة فتتواجد الإلكترونات، وهي جزيئات ذات شحنة سالبة لها مدارات حول نواة الذرة تدور بها، كما أن شحنتها السالبة تعادل شحنة البروتونات الموجبة مما يجعل الذرة متعادلة كهربائيًا في حالة الاستقرار.
شاهد أيضًا: ما هو التوزيع الالكتروني للسيليكون
بحث عن التوزيع الإلكتروني
في فهم ذرة العناصر لا بدّ من فهم آليّة التوزيع الإلكتروني لكل من المُكونات الثلاثة من بروتونات ونيوترونات وإلكترونات تدورُ في مدارات ثابتّة ومستقرة، وسيكونُ ذلك تتابعًا على نحوِ الوتيرة الآتية:
تعريف الذرة
الذرةُ هيّ أصغر وحدّة في كلُ عنصر، وهيّ أساسُ البناء والتكويّن، تتألف من نواة بروتونات مشحونة بشحنة إيجابية، ونيوترونات معتدلة الشحنة، وإلكترونات سالبة الشحنة، وجميعها تدور حول النواة، وفي طبيعة بناء الذرة فإنها مُتعادلةُ الشحنّة، ويعتمد حجم الذرة على عدد البروتونات والنيوترونات التي تتكون منها، وما إن كانت تحتوي على إلكترونات، ويبلغ حجم الذرة النموذجية حوالي 0.1 نانمتر، ومعظم حجمها عبارة عن مساحة فارغة، وهي مكان تواجد الإلكترونات، وعادة تكون الذرات الصغيرة متماثلة في الشكل، بحيث تكون بشكل كروي.[1]
عدد الإلكترونات في المدار
كلُ عنصر من عناصر الجدولُ الدوريّ يتكونُ في أساسه الإلكترونيّ من ذرة مكونة من البروتونات، والنيترونات، والإلكترونات، وتتميزُ الإلكترونات بأنها ذاتْ شحنة سالبّة، تتواجدُ حول النواة في مدارات، بحيثُ تحدد هذه المدارات بحجم الفراغ الذي قد توجد به الإلكترونات بنسبة محتملة تبلغ 95%، ويتّسع المدار الواحد الذي يوجد ضمن المدارات الأربعة المختلفة (s، p، f، d) لإلكترونين اثنين، كما قد تحمل المستويات الثانويّة في مدارات (p، f، d)، ما عدا المدار s، عددًا أكبر من الإلكترونات، بالإضافة لاختلاف عدد الإلكترونات الأقصى الذي قد تحمله الأغلفة الداخلية لأنواع المدارات المختلفة.[2]
نمط توزيع الإلكترونات في المدارات
يوجدُ نمط محدد لترتيب الإلكترونات في المداراتِ وهوّ (1s، 2s، 2p، 3s، 3p، 4s، 3d، 4p، 5p، 6s، 4f، 5d، 6p، 7s، 5f)، ويمكن أن يحمل كل مدار من هذه المدارات إلكترونين فقط، أي أنه يمكن أن يحمل مدار s، p، d إلكترونيا فقط، إلا أنه يوجد المزيد من المدارات داخل f، d مقارنة بمدارات p، s، ولذلك يمكن أن يحمل كل نوع من هذه المدارات الداخلية عددًا محددًا من الإلكترونات على النحو الآتي: مدار s يحمل إلكترونين فقطَ، أما مدارُ p فيحملُ ستة إلكترونات، ومدار d يحمل عشرة إلكترونات، ومدارُ f يحملُ أربعة عشر إلكترونًا.[3]
قواعد التوزيع الإلكتروني للعناصر
يُعبر التوزيع الإلكتروني للعنصرِ عن كيفية ترتيب الإلكترونات في مستويات الطاقة حول نواة العنصر، ويمكنُ معرفة كيفية توزيع الإلكترونات في مدراتها من خلالِ الآتي:
ترتيب المدارات
تُرتبُ المدارات حول نواة ذرة العنصر على النحو الآتي:
- المدارُ k: يُعبر عن المدار الأول والأقرب للنواة.
- المدار L: يعبر عن المدار الثاني.
- المدار M: يعبر عن المدار الثالث.
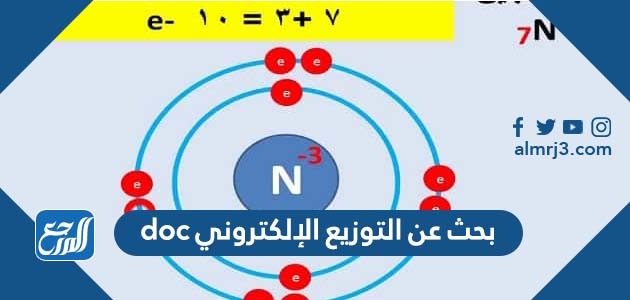
- المدار N: يعبر عن المدار الرابع، والأكبر بعدًا عن نواة العنصر.
شاهد أيضًا: التوزيع الإلكتروني الصحيح لعنصر الألومنيوم al13 هو
التوزيع الإلكتروني
توزعُ الإلكترونات في مدارات الطاقة حول النواة بشكل ثابت يبدأ من إلكترونيا ثم ثمانيّة إلكترونات ثم ستة عشر إلكترونًا نهايّة باثنين وثلاثين إلكترونًا بحيث تكون مرتبة منْ المدار الأول K انتقالاً إلى المدار الثاني L ثم الثالث M ومن ثم N، بحيث لا يمكن الانتقال إلى المدار الثاني إلا عند امتلاء المدار الأول بالإلكترونات، ومن الجدير بالذكر أنه ليس بالضرورة أن تمتلئ جميع المدارات بالإلكترونات، فهذا يختلف تبعًا للعنصر حيث إن العناصر المختلفة تمتلك أعداد إلكترونات مختلفة.
سعة المدارات
تعبرُ سعة مدار الطاقة حول نواة ذرة العنصر عن احتمالية المدار لوجود عدد مُعين من الإلكترونات، حيثُ أن أكبر عدد إلكترونات يتواجدَ في المدار هوَ نتاج 2n2، حيث أن n يرمز إلى رقم المدار، ومن هنا يمكن معرفة أكبر سعة ممكنة لكل مدار كما يلي:
- أكبرُ سعة للمدار الأول هيّ إلكترونان فقط وفقًا لمعادلةِ 2(1)2
- أكبرُ سعة للمدار الثاني هيّ ثمانية إلكترونات فقط وفقًا لمعادلة 2(2)2
- أكبرُ سعة للمدار الثالث هي ثمانية عشر إلكترونًا وفقًا لمعادلة 2(3)2
- أكبرُ سعة للمدار الرابع هي اثنينْ وثلاثون إلكترونًا وفقًا لمعادلةِ 2(4)2
مستويات الطاقة
تختلف مستويات الطاقة بيّن كل مدار بالترتيب، حيثُ أنها تبدأ بالزيادةِ انتقالاً إلى المدار الأعلى، فالمدار الأول يحمل أقل مستوى من الطاقة، والمدار الأخير يحمل أكثر مستوى من الطاقة، أي أن الزيادة تبدأ تصاعديًا من الأول حتى الأعلى، ويتم توزيع مستويات الطاقة كالآتي:
- المدار k: مستوى الطاقة الأول والأقل.
- المدار L: مستوى الطاقة الثاني.
- المدار M: مستوى الطاقة الثالث.
- المدار N: مستوى الطاقة الرابع والأعلى.
المدارات الفرعية حول النواة
يوجدُ حول نواة ذرة العنصر أربعة مدارات رئيسيّة تتوزعُ في مدارات طاقة متفاوتّة، ولكل مدار رئيسيّ مجموعة من المدارات الفرعيّة التي تختلف في العدد وفقًا لتابِعها، بحيثُ تتوزع على النحو الآتي:
- المدار k: يحتوي مدار فرعيّ واحد 1s.
- المدار L: يحتوي على المداريّن 2s و 2p.
- المدار M: يحتوي على ثلاثة مدارات فرعية وهي 3s و 3p و 3d.
- المدار N: يحتوي على أربعة مدارات فرعية وهي 4s و 4p و 4d و 4f.
السعة الإلكترونية للمدارات الفرعية
تعرف السعة الإلكترونية لأي مدار فرعيّ تابع للمدار الرئيسيّ حول نواة ذرة العنصر من خلال قانون: 2× (2l + 1)، على النحو الآتي:
- المدار K: يحتوي على مدار فرعي واحد، حيثُ أنّ i = 0 ، (2*0 +1) في 1s.
- المدار L: يحتوي على مدارين فرعيين، فإن i يساوي صفر في 2s ويساوي 1 في 2p.
- المدار M: يحتوي على ثلاثة مدارات فرعية، فإن i يساوي صفر في 3s وواحد في 3p واثنين في 3d.
- المدار N: يحتوي على أربعة مدارات فرعية، فإن i يساوي صفر في 4s وواحد في 4d واثنين في 4p وثلاثة في 4f.
أكبر عدد يمكن أن تسعه المدارات الفرعية
يمكنُ حساب أكبر عدد تسعه المدارات الفرعية من الإلكترونات من خلال قانون 2× (2l + 1)، أي بتعويض قيمة I في المعادلة على النحو الآتي:
- عدد إلكترونات في المدار s تساوي 2× (2l + 1) = 2× (2(0) + 1) = إلكترونان.
- عدد الإلكترونات في المدار p تساوي 2× (2l + 1) = 2× (2(1) + 1) = ستة إلكترونات.
- عدد الإلكترونات في المدار d تساوي 2× (2l + 1) = 2× (2(2) + 1) = عشرة إلكترونات.
- عدد الإلكترونات في المدار f تساوي 2× (2l + 1) = 2× (2(3) + 1) = أربعة عشر إلكترون.
أمثلة على التوزيع الإلكتروني
فيّما يأتي مجموعة من الأمثلةِ التوضيحية للتوزيع الإلكتروني لمختلف ذرات العناصر:
- المثالُ الأول: اكتب التوزيع الإلكتروني لذرة الأكسجين O عددها الذريّ يساويّ 8 ؟
الحل: في المدار الأول يوجد إلكترونان، وفي المدار الأخير يوجدُ ستة إلكترونات. - المثال الثاني: اكتب التوزيع الإلكتروني لذرة الصوديوم Na عددها الذري يساوي 11؟
الحل: في المدار الأول يوجد إلكترونان، وفي المدار الثاني يوجد ثمانية إلكترونات، أما المدار الأخير فيوجدُ به إلكترون واحد. - المثال الثالث: اكتب الذرة الإلكتروني لذرة الكالسيوم Ca عددها الذري يساوي 20؟
الحل: في المدار الأول يوجد إلكترونان، وفي المدار الثاني يوجد ثمانية، وفي المدار الثالث يوجد ثمانية، والمدار الأخير يوجد إلكترونيا.
خاتمة بحث عن التوزيع الإلكتروني
الذرّة هي أصغرُ عنصر في المادّة، تتكونُ في ذاتها منْ البروتونات مُوجبة الشحنة، والنيوترونات متعادلة الشحنّة، والإلكترونات سالبّة الشحنة، أما الإلكترونات فإنها تدورُ في مدارات ثابتة حولُ النواة، لكنها مختلفة في مستوى طاقتها، وكل مدار يتسع لعدد معيّن فقط من الإلكترونات، ويمكن معرفة التوزيع الإلكتروني لأي ذرة عنصر باتباع ثلاث قواعد أساسيّة، وهيّ سعة المدارات، ومستويات الطاقة، والمدارات الفرعيّة التابعة لكل مدار رئيسي في نواة الذرة.
شاهد أيضًا: تحتوي ذرة عنصر على 13 إلكتروناً كم إلكتروناً يظهر في التمثيل النقطي للإلكترونات؟
بحث عن التوزيع الإلكتروني doc
عند دراسة التوزيع الإلكتروني للعنصر فإنه يجب بداية فهم طبيعة الذرة وُمكوناتها من بروتونات ونيوترونات وإلكترونات، ثم كيفية توزيع الإلكترونات في مدارات حوّل الذرة، بحيثُ تبدأ بوجود إلكترونين في المدار الأول، ثم ثمانية إلكترونات في المدار الثاني، ثم ثمانية عشر إلكترونًا في المدار الثالث، انتهاء باثنين وثلاثين إلكترونًا في المدار الأخير، ويمكنُ فهم التوزيع الإلكتروني بشكل مبسط من خلالَ بحث أدرجناه بصيغة doc “من هنا“.
شاهد أيضًا: اذا احتوى الجزيء على توزيع منتظم للالكترونات وصف بانه
بحث عن التوزيع الإلكتروني pdf
في بحثنا عن التوزيعِ الإلكتروني أدرجنا بدايّة تعريف الذرّة، ثمّ عدد الإلكترونات في المدار، انتقالاً إلى نمط توزيع الإلكترونات في المدارات، انتقالاً إلى قواعد التوزيع الإلكتروني للعناصر، ثم المدارات الفرعية حول النواة، انتهاء بمجموعة من الأمثلة الموضحة لكيفية التوزيع الإلكتروني، ويمكنكم تحميل بحثِ عن التوزيعِ الإلكتروني بصيغة pdf “من هنا“.
إلى هنا نكون قد وصلنا إلى نهاية مقالنا بحث عن التوزيع الإلكتروني doc، حيثُ سلطنا الضوء على كل ما يتعلق بكيفية التوزيع الإلكترونيّ لذرات العناصر بمستويات مداريّة مختلفة.
المراجع
- britannica.com , atom , 19/06/2022
- chem.libretexts.org , Electronic Configurations Intro , 19/06/2022
- thoughtco.com , S P D F Orbitals and Angular Momentum Quantum Numbers , 19/06/2022




















