ما هو اول عنصر في الجدول الدوري
جدول المحتويات
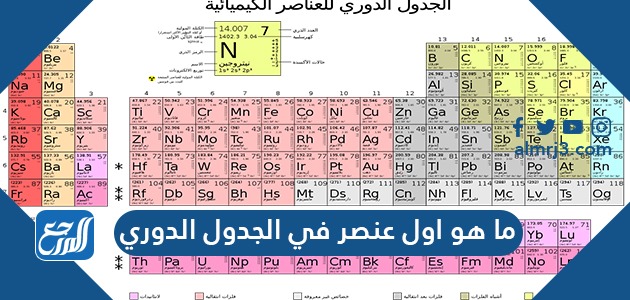
ما هو اول عنصر في الجدول الدوري حيث إن الجدول الدوري يُستعمل للعناصر على أوسع نطاق في مجال الكيمياء من أجل البحث عن العناصر الكيميائية مثلما هي مرتبة بشكل يعرض الاتجاهات الدورية في الخصائص الكيميائية للعناصر، وبالرغم من هذا، فإن الجدول الدوري يوضح بطريقة عامة رمز العنصر فقط وليس الاسم الكامل له، وعن طريق موقع المرجع سنتحدث عن ما هو أول عنصر في الجدول الدوري.
ما هو اول عنصر في الجدول الدوري
خصائص الهيدروجين
- الرقم الذري للهيدروجين هو 1، وكذلك له إلكترون واحد، وبروتون واحد.
- الكتلة الذرية للهيدروجين هي (1.008)، حيث يتضمن على ثلاثة نظائر كتلتها، ولكن إضافة وحدة كتلة ذرية واحدة فقط تدل على مضاعفة كتلته.
- بما أن المستوى الخارجي له يمتلك إلكترون واحد فقط، فإن الهيدروجين يشتمل على خصائص مؤكسدة واختزالية، حيث إنه في حال سلّم إلكترونه، فقد يترك الهيدروجين مع مدار حر، وهو ما يمكنه أن يُكوْن روابط كيميائية تبعًا لآلية متقبل المانح.
- يستطيع الهيدروجين السائل تجميد الجلد بطريقة شديدة عند ملامسته فقط.
- في الأوقات العادية له، يكون الهيدروجين عبارة عن غاز لا يمتلك لون، رائحة، أو طعم، كما يكون قابل للاشتعال، وأيضًا الانفجار.
- عند وجوده في وسط به ضغط عالي، فإنه يتكون على هيئة بلورات صلبة شبيهة للثلج.
استخدامات الهيدروجين
يدخل الهيدروجين في العديد من التطبيقات المختلفة نتيجة طبيعته المزدوجة، لذا في التالي مجموعة من الاستخدامات الأكثر شيوعًا للهيدروجين:[3]
- يستعمل الهيدروجين في تصنيع الأمونيا، بالإضافة إلى تصنيع الأسمدة النيتروجينية.
- يمكن من خلاله هدرجة الزيوت النباتية الغير مشبعة من أجل إنتاج دهون (الفاناسباتي).
- يتم استعماله في تصنيع الكثير من المركبات العضوية، مثل (الميثانول).
- تحضير كلوريد الهيدروجين، وهو عبارة عن مادة كيميائية مفيدة بشكل كبير.
- يستعمل كنوع من الوقود للصواريخ في الكثير من الأنشطة الخاصة بأبحاث الفضاء.
اقرأ أيضًا: علماء الكيمياء المسلمين وإنجازاتهم
عناصر الجدول الدوري ورموزها
- الهيدروجين: (H).
- الهليوم: (He).
- ليثيوم: (Li).
- البريليوم: (Be).
- البورون: (B).
- الكربون: (C).
- النيتروجين: (N).
- الأكسجين: (O)
- الفلور: (F).
- نيون: (Ne).
شاهد أيضًا: اسهامات نيوتن في الفيزياء
خصائص الجدول الدوري
الجدول الدوري، أو ما يُعرف باسم (جدول مندليف)، هو عبارة عن جدول يتضمن العناصر الكيميائية التي تم اكتشافها على مر العصور، إذ تم ترتيب تلك العناصر بناءً على الزيادة في أعدادها الذرية، كما ترتبت العناصر المتشابهة في الخواص في ذات الصف أو العمود، لذا فهو يُعد واحدًا من أهم الأدوات التي يتم استعمالها في الكيمياء بطريقة خاصة، وعامة في العلوم، ويجدر ذكر أن للجدول الدوري بعض الخصائص، والتي سوف تُذكر في الآتي:[5]
- يمكن استعمال الجدول بغرض التنبؤ بخصائص العناصر، وكذلك تلك العناصر التي لم تُكتشف بعد.
- تدل الأعمدة (المجموعات) والصفوف (الفترات) على العناصر التي تشترك معًا في الخصائص المتشابهة.
- يسهل الجدول فهم اتجاهات خصائص العنصر.
- يوفر معلومات هامة تستعمل بهدف موازنة المعادلات الكيميائية.
- غالبية العناصر في الجدول الدوري عبارة عن معادن، وهي المعادن القلوية، المعادن القلوية الترابية، المعادن الأساسية، والمعادن الانتقالية.
- يمتلك الجدول الدوري سبع دورات أفقية.
مجموعات الجدول الدوري
-
المعادن القلوية: تكوّن الفلزات القلوية غالبية المجموعة الأولى، وتوجد في العمود الأول بالجدول، حيث إنها لامعة وناعمة بما يعتبر كافيًا من أجل تقطيعها بواسطة سكين، كما أن بداية تلك المعادن هي الليثيوم (Li)، ونهايتها الفرانسيوم (Fr)، بالإضافة إلى أنها شديدة التفاعل، حيث سوف تشتعل في اللهب، أو قد تنفجر حين تلامس الماء، لذا يعمل الكيميائيون على تخزينها في زيوت أو غازات خاملة.
-
الفلزات القلوية الترابية: تُشكل الفلزات القلوية الترابية المجموعة الثانية من الجدول الدوري، وتبدأ من البريليوم (Be) وتنتهي عند الراديوم (Ra)، حيث يتضمن كل عنصر من تلك العناصر على إلكترونين في أقصى مستوى للطاقة، مما أدى إلى جعل الأتربة القلوية تفاعلية بدرجة تكفي، بينما أنها ليست تفاعلية مثل الفلزات القلوية، إذ تتم تفاعلاتهم الكيميائية غالبًا بطريقة أبطأ، وينتج عنها حرارة أقل.
-
اللانثانيدات: تعتبر المجموعة الثالثة طويلة جدًا، إذ أنها لا تتناسب مع العمود الثالث، لذا يتم تقسيمها وتقليبها إلى الجانب حتى تصبح الصف العلوي من الجزيرة الذي يطفو في أسفل الجدول، وتحتوي هذه المجموعة على العناصر من 57 إلى 71، والتي تبدأ من اللانثانم (La) وتنتهي عند اللوتيتيوم (Lu)، كما أن عناصر تلك المجموعة تمتلك لونًا أبيضًا فضيًا، ولكن يحدث لها تشوه إذا لامست الهواء.
-
الأكتينيدات: تتواجد الأكتينيدات في الصف السفلي من الجزيرة، كما تتشكل بدايةً من العنصر 89، وهو الأكتينيوم (Ac)، وتكون نهايتها عند العنصر رقم 103، وهو اللورنسيوم (Lr)، بالإضافة إلى أنه من بينها فقط يوجد الثوريوم (Th) واليورانيوم (U) بكميات كبيرة وطبيعية على الأرض، ولكن جميعها مشبعة، في حين أن الأكتينيدات واللانثانيدات يشكلان معًا مجموعة تُعرف باسم المعادن الانتقالية الداخلية.
وبذلك نكون قد تناولنا ما هو اول عنصر في الجدول الدوري، وأيضًا تحدثنا عن عناصر الجدول الدوري ورموزها، إلى جانب خصائص الجدول الدوري، وكذلك ذكرنا بعضًا من مجموعات الجدول الدوري.
المراجع
- encyclopedia.com , Hydrogen , 14/07/2021
- melscience.com , Hydrogen’s characteristics, properties, and interactions with oxygen , 14/07/2021
- byjus.com , Uses Of Hydrogen , 14/07/2021
- byjus.com , 118 Elements and Their Symbols and Atomic Numbers , 14/07/2021
- thoughtco.com , Why Is the Periodic Table Important? , 14/07/2021
- livescience.com , How Are Elements Grouped in the Periodic Table? , 14/07/2021




























