هل الماء قطبي أم غير قطبي

جدول المحتويات
هل الماء قطبي أم غير قطبي، إنَّ القطبية الكيميائية هي أحد المصطلحات العلمية الكيميائية التي تعني فصل الشحنات الكهربائية إلى جزيئات، مما يكسب المادة عزم ثنائي القطب أو متعدد، وسنتعرف من خلال موقع المرجع على ما هي القطبية، وكيف يمكن تحديد القطبية، وهل الماء قطبي أم غير قطبي، كما سنذكر أهمية قطبية الماء، وسنتحدث عن المركبات الأيونية.
ما هي القطبية؟
إنَّ القطبية هي مصطلح كيميائي يشير إلى فصل الشحنات الكهربائية جزئيًا في الجزيء؛ مما يؤدي إلى إكسابه عزم ثنائي القطب، أو عزم متعدد القطبية، وتترابط الجزيئات القطبية عبر قوى بين جزيئية قطبية والرابطة الهيدروجينية، وتعتمد القطبية الجزئية بشكل أساسي على اختلاف السالبية الكهربائية بالنسبة للذرات المختلفة التي تكون الجزيء، وتؤثر القطبية الكهربائية على الكثير من الخصائص كالانحلالية والتوتر السطحي ونقطة الغليان ونقطة الانصهار.
شاهد أيضًا: ما المقصود بالقول ان للماء روابط مشتركة قطبية
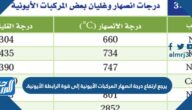
كيف يمكن تحديد القطبية؟
يتم تحديد القطبية من خلال مفهوم الكهربية، والتي تشير إلى ميل الذرة لجذب الإلكترونات في الرابطة الكيميائية، ويتم حساب هذا الميل من خلال الفرق في سلبيات الإلكترون للذرات المعنية، فإذا كان الفرق ما بين 0.4 و 1.7 فإنَّ الرابطة قطبية، أما إن كان الفرق أقل من 0.4 فإن الرابطة تكون تساهمية غير قطبية، ويوجد حينها تقاسم متساوٍ للإلكترونات بين الذرات.
هل الماء قطبي أم غير قطبي
يعد الماء مركب قطبي؛ بسبب عدم التوازن في توزيع الإلكترونات بين ذرات الأكسجين المترابطة مع ذرات الهيدروجين، أي أن المشاركة غير متكافئة للإلكترونات، ويكتب الماء على صيغة H2O، ويأخذ الهيدروجين رقم 1 في الجدول الدوري، بينما الأكسجين يحمل رقم 14، وينتج عن ذلك تكوين الأكسجين 2.8.4، أما الهيدروجين 1، فعندما يحدث اتحاد بين ذرات الهيدروجين مع ذرة واحدة من الأكسجين، يقوم إلكترونان من الأربعة إلكترونات الموجودة في الأكسجين بتشكيل رابطة قوية في الماء، ويبقى إلكترونان آخرين غير مستخدمين، لذلك فإن المشاركة للإلكترونات غير متكافئة.[1]
شاهد أيضًا: الروابط القطبية تتشارك بالإلكترونات بالتساوي
ما أهمية قطبية الماء؟
كون الماء مركب قطبي يجعل له العديد من الخصائص الفريدة، والتي أهمها قدرته على إذابة المواد المختلفة، كما أنه يحتوي على روابط قوية تربط بين الجزيئات بحزم، وهذا ما يجعل الماء أساس الحفاظ على الحياة، وتتمثل أهميته في الآتي:
- قدرة الماء على إذابة المواد: لأنه يحتوي على أيونات موجبة الشحنة، أو أيونات سالبة الشحنة، فيمكنه بذلك إذابة المواد.
- كثافة الماء عند التجميد: كثافة الماء أعلى من كثافة الجليد، وهذا يسهم في تعويم الجليد على الماء، حيث أن جزيئات الماء في الماء المتجمد تكون على شكل حزم متباعدة عن بعضها البعض وتربط بينها رابط هيدروجينية، وعندما تصل درجات حرارة التبريد إلى أربع درجات مئوية أو أقل تنخفض الكثافة، فيطفو الجليد على سطح الماء، وها بشأنه يدعم الحية البحرية.
المركبات الأيونية
المركبات الأيونية هي شكل من أشكال المركبات القطبية، وتتشكل بفعل تفاعل عنصرين أحدهما فلزي يتكون من ذرات تفقد إلكتروناتها بسهولة، والآخر لا فلزي يميل إلى اكتساب الإلكترونات بسهولة، فيتم نقل الإلكترونات من أجل تركيب الأيونات، وتساهم قوى الجذب الكهروستاتيكية في تحقيق الاستقرار بداخل المركب الأيوني، وتتشكل حينها الروابط الأيونية، ومن أشكال المركبات الأيونية ملح الطعام.
شاهد أيضًا: الجزيئات الغير قطبية يتم مشاركة الالكترونات فيها بشكل متساو
إلى هنا نكون قد وصلنا إلى ختام مقالنا الذي تعرفنا من خلاله على ما هي القطبية، وكيف يمكن تحديد القطبية، وهل الماء قطبي أم غير قطبي، كما ذكرنا أهمية قطبية الماء، وتحدثنا عن المركبات الأيونية.
المراجع
- manoa.hawaii.edu , Types of Covalent Bonds: Polar and Nonpolar , 17/06/2022